maltasiska
| Alfa-glukosidas- | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| identifierare | |||||||||
| EG nr. | 3.2.1.20 | ||||||||
| CAS-nr. | 9001-42-7 | ||||||||
| Databaser | |||||||||
| IntEnz | IntEnz-vy | ||||||||
| BRENDA | BRENDA inträde | ||||||||
| ExPASy | NiceZyme-vy | ||||||||
| KEGG | KEGG inträde | ||||||||
| MetaCyc | Metabolisk väg | ||||||||
| PRIAM | profil | ||||||||
| PDB- strukturer | RCSB PDB PDBe PDB summa | ||||||||
| |||||||||
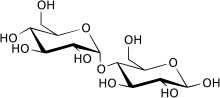
Maltas ( EC 3.2.1.20 , alfa-glukosidas , glukoinvertas , glukosidosukras , maltas-glukosamylas , alfa-glukopyranosidas , glukosidoinvertas , alfa-D-glukosidas , alfa-glukosid alfa-lucosid, alfa-lucosid-hydrolase , pha-lucosidag , alfa-glukosid-1 glukohydrolas ) är en typ av alfa-glukosidas -enzymer som finns i tunntarmens borstkant. Detta enzym katalyserar hydrolysen av disackaridmaltos till två enkla sockerarter av glukos . Maltas finns i växter, bakterier, jäst, människor och andra ryggradsdjur. Det tros syntetiseras av celler i slemhinnan som kantar tarmväggen.
Digestion av stärkelse kräver sex tarminnzymer. Två av dessa enzymer är luminala endo-glukosidaser benämnda alfa-amylaser. De andra fyra enzymerna har identifierats som olika maltaser, exo-glukosidaser bundna till enterocyternas luminala yta. Två av dessa maltasaktiviteter var associerade med sukras-isomaltas (maltas Ib, maltas la). De andra två maltaserna utan några särskiljande egenskaper benämndes maltas-glukoamylas (maltas II och III). Aktiviteterna för dessa fyra maltaser beskrivs också som alfa-glukosidas eftersom de alla smälter linjära stärkelseoligosackarider till glukos.
I de flesta fall är det ekvivalent med alfa-glukosidas , men termen "maltas" betonar disackaridnaturen hos substratet från vilket glukos klyvs, och "alfa-glukosidas" betonar bindningen, oavsett om substratet är en disackarid eller polysackarid . [ citat behövs ]
Vampyrfladdermöss är de enda ryggradsdjur som är kända för att inte uppvisa intestinal maltasaktivitet.
Strukturera
Maltas är en del av en grupp av intestinala enzymer som kallas FamilyGH13 ( Glycoside hydrolase family 13 ) som är ansvariga för att bryta isär α-glukosidasbindningarna av komplexa kolhydrater till enkla att använda glukosmolekyler. Glukosmolekylerna skulle sedan användas som ett slags "mat" för celler för att producera energi ( adenosintrifosfat) under cellandning . Följande är gener som kan koda för maltas:
- Surt alfa-glukosidas som kodas på GAA-genen är väsentligt för att bryta ner komplexa sockerarter som kallas glykogen till glukos.
- Maltas-glukoamylas som kodas på MGAM-genen spelar en roll vid nedbrytningen av stärkelse. Det är på grund av detta enzym hos människor som stärkelse av vegetabiliskt ursprung kan smälta.
- Sukras-isomaltas som kodas på SI-genen är väsentligt för nedbrytningen av kolhydrater inklusive stärkelse, sackaros och isomaltos.
- Alfa-amylas 1 som kodas på AMY1A-genen är ansvarig för att klyva a-glukosidasbindningar i oligosackarider och polysackarider för att producera stärkelse och glykogen för de tidigare enzymerna att katalysera. Högre mängder av denna gen i hjärnan har visat sig minska risken för Alzheimers sjukdom .
Mekanism
Mekanismen för alla FamilyGH13-enzymer är att bryta en α-glukosidaskoppling genom att hydrolysera den. Maltase fokuserar på att bryta isär maltos, en disackarid som är en länk mellan 2 enheter glukos, vid α-(1->4)-bindningen. Hydrolyshastigheten styrs av storleken på substratet (kolhydratstorlek).
Industriella tillämpningar
Alfa-amylas har en viktig funktion vid nedbrytning av stärkelse, så det är extremt vanligt i bageriindustrin. Det används mest som ett sätt att förbättra smaken för att förbättra brödkvaliteten. Utan alfa-amylas skulle jäst inte kunna jäsa.
Maltos-glukosamylas används vanligtvis som en jäsningskälla eftersom det kan skära stärkelse till maltos, som sedan används för att brygga öl och sake.
Förutom bryggning har maltosglukoamylas studerats genom att introducera specifika inhibitorer för att stoppa hydrolysen av α-glukosidasbindningarna. Genom att hämma klyvningen av kopplingarna, hoppas forskarna kunna ta fram ett läkemedel som är mer effektivt och mindre giftigt för behandling av diabetes.
Historia
Historien om upptäckten av maltas började när Napoleon Bonaparte deklarerade en kontinental blockad i sitt "Berlin-dekret" 1806. Detta inledde sökandet efter alternativa sockerkällor. 1833 upptäckte de franska kemisterna Anselm Payen och Jean-Francois Persoz ett maltextrakt som omvandlade stärkelse till glukos som de kallade diastas på den tiden. År 1880 upptäckte HT Brown mukosal maltasaktivitet och särskiljde den från diastas, nu kallad amylas. På 1960-talet gjorde framstegen inom proteinkemin det möjligt för Arne Dahlqvist och Giorgio Semenza att fraktionera och karakterisera tunntarmsmaltasaktiviteter. Båda grupperna visade att det fanns fyra huvudfraktioner av maltasaktivitet som var inneboende i två olika peptidstrukturer, sukras-isomaltas och maltas-glukoamylas. Femtio år senare in i den genomiska åldern, bekräftade kloning och sekvensering av slemhinnestärkelsehydrolaset Dahlqvist och Semenzas fynd.
Maltasbrist
Syra maltasbrist (AMD) även känd som Pompes sjukdom beskrevs första gången av den holländska patologen JC Pompe 1932. AMD är ett icke könsbundet autosomalt recessivt tillstånd där överdriven ackumulering av glykogen byggs upp i lysosomvakuoler i nästan alla typer av celler överallt. kroppen. Det är en av de allvarligare glykogenlagringssjukdomarna som påverkar muskelvävnad.
AMD kategoriseras i tre olika typer baserat på åldern för debut av symtom hos den drabbade individen. Infantil (typ a), barndom (typ b) och vuxen ålder (typ c). Typen av AMD bestäms av typen av genmutation lokaliserad på 17q23. Mutationstyp kommer att bestämma produktionsnivån för surt maltas. AMD är extremt dödligt. Typ en vanligen dör av hjärtsvikt före ett års ålder. Typ b dör av andningssvikt mellan tre till tjugofyra år. Typ c dör av andningssvikt 10-20 år efter symtomdebut.
Se även
externa länkar
- Maltaser vid US National Library of Medicine Medical Subject Headings (MeSH)
- Struktur och utveckling av däggdjursmaltas-glukoamylas och sukras-isomaltas