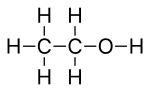
Skelettformel
Skelettformeln eller linjevinkelformeln eller stenografiformeln för en organisk förening är en typ av molekylär strukturformel som fungerar som en kortfattad representation av en molekyls bindning och några detaljer om dess molekylära geometri . En skelettformel visar skelettstrukturen eller skelettet av en molekyl, som är sammansatt av de skelettatomer som utgör molekylen. Det är representerat i två dimensioner, som på ett papper. Den använder vissa konventioner för att representera kol- och väteatomer , som är de vanligaste inom organisk kemi.
En tidig form av denna representation utvecklades först av den organiska kemisten August Kekulé , medan den moderna formen är nära besläktad med och påverkad av Lewis-strukturen av molekyler och deras valenselektroner. Därför kallas de ibland för Kekulé-strukturer eller Lewis-Kekulé-strukturer . Skelettformler har blivit allestädes närvarande i organisk kemi , dels för att de är relativt snabba och enkla att rita, och också för att den krökta pilnotationen som används för diskussioner om reaktionsmekanismer och elektrondelokalisering lätt kan överlagras.
Flera andra sätt att avbilda kemiska strukturer används också ofta inom organisk kemi (men mindre frekvent än skelettformler). Till exempel ser konformationsstrukturer ut som skelettformler och används för att skildra atomernas ungefärliga positioner i 3D-rymden, som en perspektivritning. Andra typer av representation, som Newman-projektion , Haworth-projektion eller Fischer-projektion , ser också något ut som skelettformler. Det finns dock små skillnader i de konventioner som används, och läsaren måste vara medveten om dem för att förstå de strukturella detaljerna som kodas i avbildningen. Medan skelett- och konformationsstrukturer också används i metallorganisk och oorganisk kemi , skiljer sig de använda konventionerna också något.
Skelettet
Terminologi
Skelettstrukturen hos en organisk förening är den serie av atomer som är sammanbundna som bildar föreningens väsentliga struktur. Skelettet kan bestå av kedjor, grenar och/eller ringar av bundna atomer. Andra skelettatomer än kol eller väte kallas heteroatomer .
Skelettet har väte och/eller olika substituenter bundna till sina atomer. Väte är den vanligaste icke-kolatomen som är bunden till kol och för enkelhets skull är den inte uttryckligen ritad. Dessutom är kolatomer i allmänhet inte märkta som sådana direkt (dvs med "C"), medan heteroatomer alltid uttryckligen anges som sådana ("N" för kväve, " O " för syre , etc.)
Heteroatomer och andra grupper av atomer som ger upphov till relativt höga hastigheter av kemisk reaktivitet, eller introducerar specifika och intressanta egenskaper i spektra av föreningar kallas funktionella grupper , eftersom de ger molekylen en funktion. Heteroatomer och funktionella grupper kallas gemensamt för "substituenter", eftersom de anses vara ett substitut för väteatomen som skulle finnas i moderkolvätet till den organiska föreningen.
Grundläggande struktur
Liksom i Lewis-strukturer indikeras kovalenta bindningar med linjesegment, med ett dubbelt eller tredubblat linjesegment som indikerar dubbel- respektive trippelbindning . På samma sätt indikerar skelettformler formella laddningar associerade med varje atom (även om ensamma par vanligtvis är valfria, se nedan ). Faktum är att skelettformler kan ses som förkortade Lewis-strukturer som observerar följande förenklingar:
- Kolatomer representeras av hörnen (skärningspunkter eller ändpunkter) av linjesegment. För tydlighetens skull skrivs metylgrupper ofta uttryckligen ut som Me eller CH 3 , medan (hetero) kumulenkol ofta representeras av en tung mittpunkt .
- Väteatomer bundna till kol antyds. En omärkt vertex förstås representera ett kol fäst till antalet väten som krävs för att uppfylla oktettregeln, medan en vertex märkt med en formell laddning och/eller icke-bindande elektron(er) förstås ha det antal väteatomer som krävs för att ge kolatomen dessa indikerade egenskaper. Eventuellt kan acetyleniska och formylväten visas explicit för tydlighetens skull.
- Väteatomer bundna till en heteroatom visas explicit. Heteroatomen och väteatomerna fästa därtill visas vanligtvis som en enda grupp (t.ex. OH, NH 2 ) utan att explicit visa väte-heteroatombindningen. Heteroatomer med enkla alkyl- eller arylsubstituenter, som metoxi (OMe) eller dimetylamino (NMe2), visas ibland på samma sätt, analogt.
- Ensamma par på karbenkol måste anges uttryckligen medan ensamma par i andra fall är valfria och visas endast för betoning. Däremot visas formella laddningar och oparade elektroner på huvudgruppselement alltid explicit.
I standardavbildningen av en molekyl ritas den kanoniska formen (resonansstrukturen) med störst bidrag. Skelettformeln förstås dock representera den "riktiga molekylen" - det vill säga det viktade medelvärdet av alla bidragande kanoniska former. Således, i de fall där två eller flera kanoniska former bidrar med lika vikt (t.ex. i bensen eller en karboxylatanjon) och en av de kanoniska formerna väljs godtyckligt, förstås skelettformeln avbilda den verkliga strukturen, innehållande ekvivalenta bindningar av bråkordning, även om de delokaliserade bindningarna är avbildade som icke-ekvivalenta enkel- och dubbelbindningar.
Samtida grafiska konventioner
Sedan skelettstrukturer introducerades under senare hälften av 1800-talet har deras utseende genomgått en betydande utveckling. De grafiska konventionerna som används idag går till 1980-talet. Tack vare antagandet av mjukvarupaketet ChemDraw som en de facto industristandard (av American Chemical Society , Royal Society of Chemistry och Gesellschaft Deutscher Chemiker- publikationer, till exempel), har dessa konventioner varit nästan universella i den kemiska litteraturen sedan slutet av 1990-talet . Några mindre konventionella variationer, särskilt med avseende på användningen av stereobindningar, fortsätter att existera som ett resultat av olika praxis i USA, Storbritannien och Europa, eller som en fråga om personlig preferens. Som en annan mindre variation mellan författare kan formella avgifter visas med plus- eller minustecknet i en cirkel (⊕, ⊖) eller utan cirkeln. Den uppsättning konventioner som följs av de flesta författare ges nedan, tillsammans med illustrativa exempel.
- Bindningar mellan sp 2 eller sp 3 hybridiserade kol eller heteroatomer representeras konventionellt med 120° vinklar närhelst det är möjligt, med den längsta kedjan av atomer som följer ett sicksackmönster om de inte avbryts av en cis- dubbelbindning. Om inte alla fyra substituenterna är explicita, är detta sant även när stereokemi avbildas med hjälp av kilade eller streckade bindningar ( se nedan ).
- Om alla fyra substituenterna till ett tetraedriskt kol är explicit visade, möts bindningar till de två substituenterna i planet fortfarande vid 120°; de andra två substituenterna visas dock vanligtvis med kilade och streckade bindningar (för att skildra stereokemi) och täcker en mindre vinkel på 60–90°.
- Den linjära geometrin vid sp-hybridiserade atomer avbildas normalt av linjesegment som möts vid 180°. Där detta involverar två dubbelbindningar som möts (en allen eller cumulen ), separeras bindningarna med en punkt.
- Karbo- och heterocykler (3- till 8-ledade) representeras i allmänhet som regelbundna polygoner; större ringstorlekar tenderar att representeras av konkava polygoner.
- Atomer i en grupp är ordnade så att bindningen utgår från atomen som är direkt fäst vid skelettet. Till exempel betecknas nitrogruppen NO 2 —NO 2 eller O 2 N— , beroende på placeringen av bindningen. Däremot betecknas den isomera nitritgruppen -ONO eller ONO- .
Implicita kol- och väteatomer
visas skelettformeln för hexan (överst) nedan. Kolatomen märkt C 1 verkar bara ha en bindning, så det måste också finnas tre väte bundna till den, för att det totala antalet bindningar ska bli fyra. Kolatomen märkt C3 har två bindningar till andra kol och är därför också bunden till två väteatomer. En Lewis-struktur (mitten) och en boll-och-stick-modell (botten) av den faktiska molekylstrukturen av hexan, som bestämts med röntgenkristallografi, visas för jämförelse.
Det spelar ingen roll från vilken ände av kedjan man börjar numrera, så länge som konsistensen bibehålls när man ritar diagram. Den kondenserade formeln eller IUPAC-namnet bekräftar orienteringen. Vissa molekyler kommer att bli bekanta oavsett orientering.
Explicita heteroatomer och väteatomer
Alla atomer som inte är kol eller väte betecknas med sin kemiska symbol , till exempel Cl för klor , O för syre , Na för natrium och så vidare. I samband med organisk kemi är dessa atomer allmänt kända som heteroatomer ( prefixet hetero- kommer från grekiskan ἕτερος héteros, som betyder "annan").
Eventuella väteatomer bundna till heteroatomer ritas explicit. I etanol , C2H5OH , till exempel, betecknas väteatomen bunden till syre med symbolen H, medan väteatomerna som är bundna till kolatomer inte visas direkt .
Linjer som representerar heteroatom-vätebindningar utelämnas vanligtvis för klarhet och kompakthet, så en funktionell grupp som hydroxylgruppen skrivs oftast −OH istället för −O−H. Dessa bindningar dras ibland ut helt för att accentuera sin närvaro när de deltar i reaktionsmekanismer .
Nedan visas för jämförelse en skelettformel (överst), dess Lewis-struktur (mitten) och dess boll-och-stick-modell (nederst) av den faktiska 3D-strukturen av etanolmolekylen i gasfasen, bestämd med mikrovågsspektroskopi .
Pseudoelementsymboler
Det finns också symboler som verkar vara kemiska elementsymboler , men representerar vissa mycket vanliga substituenter eller indikerar en ospecificerad medlem av en grupp av element. Dessa kallas pseudoelementsymboler eller organiska element och behandlas som univalenta "element" i skelettformler. En lista över vanliga pseudoelementsymboler:
Allmänna symboler
- X för valfri ( pseudo ) halogenatom (i den relaterade MLXZ-notationen representerar X en en-elektrondonatorligand)
- L eller Ln för en ligand eller ligander (i den relaterade MLXZ - notationen representerar L en tvåelektrondonatorligand)
- M eller Met för vilken metallatom som helst ([M] används för att indikera en ligerad metall, ML n , när identiteterna för liganderna är okända eller irrelevanta)
- E eller El för vilken elektrofil som helst (i vissa sammanhang används E också för att indikera alla p-blockelement )
- Nu för vilken nukleofil som helst
- Z för konjugering av elektronbortdragande grupper (i den relaterade MLXZ-notationen representerar Z en noll-elektrondonatorligand; i orelaterad användning är Z också en förkortning för karboxibensylgruppen. )
- D för deuterium ( 2 H)
- T för tritium ( 3 H)
Alkylgrupper
- R för vilken alkylgrupp som helst eller till och med vilken organylgrupp som helst (Alk kan användas för att entydigt indikera en alkylgrupp)
- Jag för metylgruppen
- Et för etylgruppen
- Pr, n -Pr eller n Pr för den ( normala ) propylgruppen ( Pr är också symbolen för grundämnet praseodym . Men eftersom propylgruppen är monovalent, medan praseodym nästan alltid är trevalent, uppstår tvetydighet sällan, om någonsin, i praktiken. )
- i - Pr eller i Pr för isopropylgruppen
- Allt för allylgruppen (ovanligt)
- Bu, n -Bu eller nBu för den ( normala butylgruppen )
- i -Bu eller i Bu ( jag har ofta kursiverats) för isobutylgruppen
- s -Bu eller sBu för den sekundära butylgruppen
- t -Bu eller tBu för den tertiära butylgruppen
- Pn för pentylgruppen ( eller Am för den synonyma amylgruppen , även om Am också är symbolen för americium . )
- Np eller Neo för neopentylgruppen ( Varning: Metallorganiska kemister använder ofta Np för den relaterade neofylgruppen , PhMe 2 C–. Np är också symbolen för grundämnet neptunium . )
- Cy eller Chx för cyklohexylgruppen
- Annons för 1 - adamantylgruppen
- Tr eller Trt för tritylgruppen
Aromatiska och omättade substituenter
- Ar för valfri aromatisk substituent (Ar är också symbolen för grundämnet argon . Argon är dock inert under alla vanliga förhållanden som förekommer i organisk kemi, så användningen av Ar för att representera en arylsubstituent orsakar aldrig förvirring.)
- Het för vilken heteroaromatisk substituent som helst
- Bn eller Bzl för bensylgruppen ( inte att förväxla med Bz för bensoylgruppen ; Men gammal litteratur kan använda Bz för bensylgruppen. )
- Dipp för 2,6-diisopropylfenylgruppen
- Mes för mesitylgruppen
- Ph, Φ eller φ för fenylgruppen ( användningen av phi för fenyl har minskat )
- Tol för tolylgruppen , vanligtvis para- isomeren
- Is eller Tipp för 2,4,6-triisopropylfenylgruppen ( den tidigare symbolen kommer från synonymen isityl )
- An för anisylgruppen , vanligtvis para- isomeren ( An är också symbolen för ett generiskt aktinoidelement. Men eftersom anisylgruppen är monovalent, medan aktiniderna vanligtvis är tvåvärda, trivalenta eller till och med högre valens, är tvetydighet sällan, om någonsin , uppstår i praktiken. )
- Cp för cyklopentadienylgruppen ( Cp var symbolen för cassiopeium, ett tidigare namn för lutetium )
- Cp * för pentametylcyklopentadienylgruppen
- Vi för vinylgruppen (ovanligt)
Funktionella grupper
- Ac för acetylgruppen (Ac är också symbolen för grundämnet aktinium . Aktinium påträffas dock nästan aldrig i organisk kemi så användningen av Ac för att representera acetylgruppen orsakar aldrig förvirring) , ;
- Bz för bensoylgruppen ; OBz är bensoatgruppen
- Piv för pivalyl ( t -butylkarbonyl)gruppen; OPiv är pivalatgruppen
- Bt för 1-bensotriazolylgruppen
- Jag för 1-imidazolylgruppen
- NPhth för ftalimid-1-ylgruppen
Sulfonyl/sulfonatgrupper
Sulfonatestrar lämnar ofta grupper i nukleofila substitutionsreaktioner. Se artiklarna om sulfonyl- och sulfonatgrupper för ytterligare information.
- Bs för brosyl- ( p -brombensensulfonyl)-gruppen; OBs är brosylatgruppen
- Ms för mesylgruppen (metansulfonyl); OMs är mesylatgruppen
- Ns för gruppen nosyl ( p -nitrobensensulfonyl) (Ns var den tidigare kemiska symbolen för bohrium , då kallad nielsbohrium) ; ONs är nosylatgruppen
- Tf för triflyl (trifluormetansulfonyl)-gruppen; OTf är triflatgruppen
- Nf för nonaflyl ( nonafluorbutansulfonyl ) -gruppen, CF3 ( CF2 ) 3S02 ; ONf är den nonaflate gruppen
- Ts för tosyl ( p- toluensulfonyl) grupp (Ts är också symbolen för grundämnet tennessine . Tennessine påträffas dock aldrig i organisk kemi, så användningen av Ts för att representera tosyl orsakar aldrig förvirring) ; OTs är tosylatgruppen
Att skydda grupper
En skyddsgrupp eller skyddsgrupp införs i en molekyl genom kemisk modifiering av en funktionell grupp för att erhålla kemoselektivitet i en efterföljande kemisk reaktion, vilket underlättar flerstegs organisk syntes.
- Boc för t butoxikarbonylgruppen -
- Cbz eller Z för karboxibensylgruppen
- Fmoc för fluorenylmetoxikarbonylgruppen
- Alloc för allyloxikarbonylgruppen
- Troc för trikloretoxikarbonylgruppen
- TMS, TBDMS, TES, TBDPS, TIPS, ... för olika silyletergrupper
- PMB för 4-metoxibensylgruppen
- MOM för metoximetylgruppen
- THP för 2-tetrahydropyranylgruppen
Flera bindningar
Två atomer kan bindas genom att dela mer än ett elektronpar. De vanligaste bindningarna till kol är enkel-, dubbel- och trippelbindningar. Enkelbindningar är vanligast och representeras av en enda heldragen linje mellan två atomer i en skelettformel. Dubbelbindningar betecknas med två parallella linjer, och trippelbindningar visas med tre parallella linjer.
I mer avancerade teorier om bindning finns icke- heltalsvärden för bindningsordning . I dessa fall indikerar en kombination av heldragna och streckade linjer heltals- respektive icke-heltalsdelarna av bindningsordningen.
Hex-3-en har en inre kol-kol dubbelbindning
Hex-1-en har en terminal dubbelbindning
Hex-3-yn har en inre kol- kol trippelbindning
Bensen ringar
På senare år har bensen i allmänhet avbildats som en hexagon med alternerande enkel- och dubbelbindningar, ungefär som strukturen Kekulé ursprungligen föreslog 1872. Som nämnts ovan förstås de alternerande enkel- och dubbelbindningarna av "1,3,5-cyklohexatrien" att vara en ritning av en av de två ekvivalenta kanoniska formerna av bensen (1,3,5- och 2,4,6-isomererna), där alla kol-kolbindningar är lika långa och har en bindningsordning av exakt 1.5. För arylringar i allmänhet är de två analoga kanoniska formerna nästan alltid de primära bidragsgivarna till strukturen, men de är inte likvärdiga, så en struktur kan ge ett något större bidrag än den andra, och bindningsordningarna kan skilja sig något från 1,5.
En alternativ representation som betonar denna delokalisering använder en cirkel, ritad inuti hexagonen av enkelbindningar, för att representera den delokaliserade pi-orbitalen . Denna stil, baserad på en föreslagen av Johannes Thiele , brukade vara mycket vanlig i inledande läroböcker i organisk kemi och används fortfarande ofta i informella miljöer. Men eftersom denna skildring inte håller reda på elektronpar och inte kan visa elektronernas exakta rörelse, har den i stort sett ersatts av den Kekuléanska skildringen i pedagogiska och formella akademiska sammanhang.
Stereokemi
Stereokemi betecknas bekvämt i skelettformler:
Ball-and-stick-modell av ( R )-2-klor-2-fluorpentan
De relevanta kemiska bindningarna kan avbildas på flera sätt:
- Heldragna linjer representerar bindningar i papprets eller skärmens plan.
- Solida kilar representerar bindningar som pekar ut från papperets eller skärmens plan, mot betraktaren.
- Hashade kilar eller streckade linjer (tjocka eller tunna) representerar bindningar som pekar in i papperets eller skärmens plan, bort från betraktaren.
- Vågiga linjer representerar antingen okänd stereokemi eller en blandning av de två möjliga stereoisomererna vid den punkten.
- En föråldrad skildring av vätestereokemi som brukade vara vanlig inom steroidkemi är användningen av en fylld cirkel centrerad på en vertex (ibland kallad H-punkt/H-streck/H-cirkel) för en uppåtriktad väteatom och två hash-markeringar bredvid vertex eller en ihålig cirkel för en nedåtriktad väteatom.
En tidig användning av denna notation kan spåras tillbaka till Richard Kuhn som 1932 använde heldragna tjocka linjer och prickade linjer i en publikation. De moderna solida och hashade kilarna introducerades på 1940-talet av Giulio Natta för att representera strukturen hos höga polymerer , och populärt i 1959 års lärobok Organic Chemistry av Donald J. Cram och George S. Hammond .
Skelettformler kan avbilda cis- och transisomerer av alkener. Vågformiga enkelbindningar är standardsättet att representera okänd eller ospecificerad stereokemi eller en blandning av isomerer (som med tetraedriska stereocentra). En korsad dubbelbindning har använts ibland; anses inte längre vara en acceptabel stil för allmänt bruk, men kan fortfarande krävas av datorprogramvara.
Vätebindningar

Vätebindningar betecknas i allmänhet med prickade eller streckade linjer. I andra sammanhang kan streckade linjer också representera delvis bildade eller brutna bindningar i ett övergångstillstånd .
Anteckningar
externa länkar
- Rita organiska molekyler från chemguide.co.uk