Poliovirus

|
|

|
|
| Poliovirus | |
|---|---|
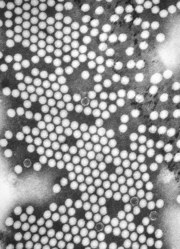
| TEM -mikrofotografi av poliovirusvirioner . Skalstapel (vit): 50 nm | |
| A typ 3 polioviruskapsid, proteinsidokedjor färgade | |
| Virusklassificering | |
| (orankad): | Virus |
| Rike : | Riboviria |
| Rike: | Orthornavirae |
| Provins: | Pisuviricota |
| Klass: | Pisoniviricetes |
| Beställa: | Picornavirales |
| Familj: | Picornaviridae |
| Släkte: | Enterovirus |
| Arter: | |
| Virus: |
Poliovirus
|
| Serotyper | |
|
|
Ett poliovirus , det orsakande medlet för polio (även känt som poliomyelit), är en serotyp av arten Enterovirus C , i familjen Picornaviridae . Det finns tre poliovirusserotyper : typ 1, 2 och 3.
Poliovirus består av ett RNA- genom och en proteinkapsid . Genomet är ett enkelsträngat positiv-sens RNA (+ssRNA)-genom som är cirka 7500 nukleotider långt. Den virala partikeln är cirka 30 nm i diameter med icosaedrisk symmetri . På grund av dess korta genom och dess enkla sammansättning - endast RNA och en icke-höljeslagen icosahedrisk proteinhölje som inkapslar det - anses poliovirus allmänt vara det enklaste signifikanta viruset.
Poliovirus isolerades först 1909 av Karl Landsteiner och Erwin Popper . Virusets struktur klargjordes först 1958 med hjälp av röntgendiffraktion av ett team vid Birkbeck College ledd av Rosalind Franklin , vilket visade att polioviruset har icosahedrisk symmetri.
År 1981 publicerades poliovirusgenomet av två olika team av forskare: av Vincent Racaniello och David Baltimore vid MIT och av Naomi Kitamura och Eckard Wimmer vid Stony Brook University .
Den tredimensionella strukturen av poliovirus bestämdes 1985 av James Hogle vid Scripps Research Institute med hjälp av röntgenkristallografi.
Poliovirus är ett av de mest välkarakteriserade virusen och har blivit ett användbart modellsystem för att förstå RNA-virusens biologi .
Replikeringscykel
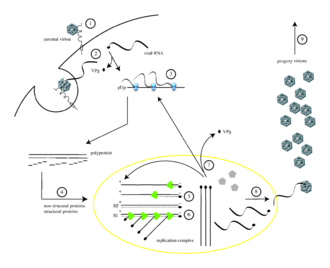
Poliovirus infekterar mänskliga celler genom att binda till en immunglobulinliknande receptor, CD155 (även känd som poliovirusreceptorn eller PVR) på cellytan. Interaktion mellan poliovirus och CD155 underlättar en irreversibel konformationsförändring av den virala partikeln som är nödvändig för virusinträde. Efter anslutning till värdcellmembranet troddes inträde av den virala nukleinsyran ske på ett av två sätt: via bildandet av en por i plasmamembranet genom vilken RNA sedan "injiceras" i värdcellens cytoplasma , eller via virusupptag genom receptormedierad endocytos . Nya experimentella bevis stöder den senare hypotesen och tyder på att poliovirus binder till CD155 och tas upp av endocytos. Omedelbart efter internalisering av partikeln frisätts det virala RNA:t.
Poliovirus är ett positivt strängat RNA-virus . Således kan genomet som är inneslutet i den virala partikeln användas som budbärar-RNA och omedelbart translateras av värdcellen. Vid inträde kapar viruset cellens översättningsmaskineri, vilket orsakar hämning av cellulär proteinsyntes till förmån för virusspecifik proteinproduktion. Till skillnad från värdcellens mRNA 5'-änden av poliovirus-RNA extremt lång – över 700 nukleotider – och mycket strukturerad. Denna region av det virala genomet kallas ett internt ribosominträdesställe (IRES). Denna region består av många sekundära strukturer och 3 eller 4 domäner. Domän 3 är ett självvikande RNA-element som innehåller konserverade strukturella motiv i olika stabila stamslingor som är sammanlänkade med två fyrvägsövergångar. Eftersom IRES består av många domäner, består dessa domäner i sig av många loopar som bidrar till modifierad translation utan en 5'-ändkapsel genom att kapa ribosomer. Interaktionsslingan för domän 3 är känd som GNRA-tetraloop. Resterna av adenosinerna A180 och A181 i GUAA-tetraloopen bildar vätebindningar via icke-kanoniska basparningsinteraktioner med basparen av receptorerna C230/G242 respektive G231/C241. Genetiska mutationer i denna region förhindrar produktion av viral protein. Det första IRES som upptäcktes hittades i poliovirus-RNA.
Poliovirus mRNA översätts som en lång polypeptid . Denna polypeptid autoklyves sedan av interna proteaser till cirka 10 individuella virala proteiner. Alla klyvningar sker inte med samma effektivitet. Därför varierar mängderna proteiner som produceras av polypeptidklyvningen: till exempel produceras mindre mängder 3D pol än de av kapsidproteiner, VP1–4. Dessa individuella virala proteiner är:
- 3D pol , ett RNA-beroende RNA-polymeras vars funktion är att göra flera kopior av det virala RNA-genomet
- 2A pro och 3C pro /3CD pro , proteaser som klyver den virala polypeptiden
- VPg (3B), ett litet protein som binder viralt RNA och är nödvändigt för syntes av viral positiv och negativ sträng RNA
- 2BC, 2B, 2C (ett ATPas) , 3AB, 3A, 3B proteiner som innefattar proteinkomplexet som behövs för virusreplikation.
- VP0, som klyvs vidare till VP2 och VP4, VP1 och VP3, proteiner av den virala kapsiden
Efter translation, transkription och genomreplikation som involverar en enda process, realiseras syntes av (+) RNA. För att det infekterande (+)RNA:t ska replikeras måste flera kopior av (−)RNA transkriberas och sedan användas som mallar för (+)RNA-syntes. Replikativa intermediärer (RI), som är en association av RNA-molekyler bestående av ett mall-RNA och flera växande RNA:n av varierande längd, ses i både replikationskomplexen för (−)RNA och (+)RNA. För syntes av varje negativ-sträng och positiv-sträng RNA, fungerar VPg-protein i polioviruset som en primer. RNA-beroende RNA-polymeras från polioviruset lägger till två uracilnukleotider (UU) till VPg-proteinet genom att använda poly(A)-svansen vid 3'-änden av +ssRNA-genomet som ett mönster för syntes av negativt-strängat antigenomiskt RNA. För att initiera denna −ssRNA-syntes behövs tyrosinhydroxylen av VPg. Men för initiering av positiv sträng RNA-syntes behövs CRE-beroende VPg-uridylylering. Vilket innebär att VPg återigen används som en primer, men den här gången lägger den till de två uridintrifosfaterna med hjälp av ett cis-verkande replikationselement (CRE) som mall.
CRE för poliovirus identifieras som en ouppnådd basparad stam och en slutlig loop bestående av 61 nt. CRE finns i enterovirus. Det är ett mycket bevarat sekundärt RNA-strukturelement och inbäddat i genomets polyproteinkodande region. Komplexet kan translokeras till 5'-regionen av genomet som inte har någon kodande aktivitet, åtminstone 3,7 kb avstånd från den initiala platsen. Denna process kan ske utan att påverka aktiviteten negativt. CRE-kopior påverkar inte replikeringen negativt. Uridylyleringsprocess av VPg som äger rum vid CRE behöver närvaron av 3CD pro som är ett RNA-bindande protein. Den är kopplad till CRE direkt och specifikt. På grund av sin närvaro kan VPg binda CRE ordentligt och primärproduktionen fortsätter utan problem.
Några av (+) RNA-molekylerna används som mallar för ytterligare (-) RNA-syntes, vissa fungerar som mRNA och några är avsedda att vara genomet av avkommavirioner.
Vid sammansättning av nya viruspartiklar (dvs. packningen av avkommans genom till en prokapsid som kan överleva utanför värdcellen), inklusive, respektive:
- Fem kopior vardera av VP0, VP3 och VP1 vars N-terminaler och VP4 bildar inre yta av kapsid, sätts samman till en "pentamer" och 12 pentamerer bildar en prokapsid. (Den yttre ytan av kapsiden består av VP1, VP2, VP3; C-ändarna av VP1 och VP3 bildar kanjonerna som runt var och en av hörnen; vid denna tidpunkt klyvs de 60 kopiorna av VP0 till VP4 och VP2.)
- Varje prokapsid erhåller en kopia av virusgenomet, med VPg fortfarande fäst vid 5'-änden.
Fullständigt sammansatt poliovirus lämnar gränserna för sin värdcell genom lys 4 till 6 timmar efter initiering av infektion i odlade däggdjursceller. Mekanismen för virusfrisättning från cellen är oklar, men varje döende cell kan frigöra upp till 10 000 poliovirioner .
Drake visade att poliovirus kan genomgå multiplicitetsreaktivering. Det vill säga när poliovirus bestrålades med UV-ljus och fick genomgå flera infektioner av värdceller, kunde livsduglig avkomma bildas även vid UV-doser som inaktiverade viruset vid enstaka infektioner. Poliovirus kan genomgå genetisk rekombination när minst två virusgenom finns närvarande i samma värdcell. Kirkegaard och Baltimore presenterade bevis för att RNA-beroende RNA-polymeras (RdRP) katalyserar rekombination genom en kopievalsmekanism där RdRP växlar mellan ( +) ssRNA- mallar under negativ strängsyntes. Rekombination i RNA-virus verkar vara en adaptiv mekanism för att reparera genomskador.
Ursprung och serotyper
Poliovirus liknar strukturellt andra humana enterovirus ( coxsackievirus , echovirus och rhinovirus ), som också använder immunglobulinliknande molekyler för att känna igen och komma in i värdceller. Fylogenetisk analys av RNA- och proteinsekvenserna för poliovirus tyder på att det kan ha utvecklats från en C-kluster Coxsackie A-virusförfader , som uppstod genom en mutation i kapsiden. Den distinkta artbildningen av poliovirus inträffade troligen som ett resultat av en förändring i cellulär receptorspecificitet från intercellulär adhesionsmolekyl-1 (ICAM-1), som används av C-kluster Coxsackie A-virus, till CD155 ; vilket leder till en förändring i patogenicitet och tillåter viruset att infektera nervvävnad.
Mutationshastigheten i viruset är relativt hög även för ett RNA-virus med en synonym substitutionshastighet på 1,0 x 10 −2 substitutioner/plats/år och icke synonym substitutionshastighet på 3,0 x 10 −4 substitutioner/plats/år. Basfördelningen inom genomet är inte slumpmässig med adenosin som är mindre vanligt än förväntat i 5'-änden och högre i 3'-änden. Kodonanvändning är inte slumpmässig, eftersom kodon som slutar på adenosin gynnas och de som slutar på cytosin eller guanin undviks. Kodonanvändning skiljer sig mellan de tre genotyperna och verkar drivas av mutation snarare än selektion.
De tre serotyperna av poliovirus, PV-1, PV-2 och PV-3, har var och en något olika kapsidprotein . Kapsidproteiner definierar cellulär receptorspecificitet och virusantigenicitet. PV-1 är den vanligaste formen som förekommer i naturen, men alla tre formerna är extremt smittsamma . Från och med mars 2020 är vild PV-1 mycket lokaliserad till regioner i Pakistan och Afghanistan. Certifiering av utrotning av inhemsk överföring skedde i september 2015 för vild PV-2, efter att ha upptäckts senast 1999, och i oktober 2019 för vild PV-3, efter att ha upptäckts senast 2012.
Specifika stammar av varje serotyp används för att framställa vacciner mot polio . Inaktivt poliovaccin framställs genom formalininaktivering av tre vilda, virulenta referensstammar, Mahoney eller Brunenders (PV-1), MEF-1/Lansing (PV-2) och Saukett/Leon (PV-3). Oralt poliovaccin innehåller levande försvagade (försvagade) stammar av de tre serotyperna av poliovirus. Att passera virusstammarna i apnjurepitelceller introducerar mutationer i det virala IRES och hindrar (eller försvagar) virusets förmåga att infektera nervvävnad.
Poliovirus klassificerades tidigare som en distinkt art som tillhörde släktet Enterovirus i familjen Picornaviridae . 2008 Poliovirus- arterna och de tre serotyperna tilldelades arten Human enterovirus C (senare omdöpt till Enterovirus C ), i släktet Enterovirus i familjen Picornaviridae . Typen av släktet Enterovirus ändrades från Poliovirus till (Humant) Enterovirus C.
Patogenes
Den primära bestämningsfaktorn för infektion för alla virus är dess förmåga att komma in i en cell och producera ytterligare infektiösa partiklar. Närvaron av CD155 tros definiera de djur och vävnader som kan infekteras av poliovirus. CD155 finns (utanför laboratorier) endast på celler från människor, högre primater och apor från gamla världen . Poliovirus är dock strikt en mänsklig patogen och infekterar inte naturligt någon annan art (även om schimpanser och apor från gamla världen kan infekteras experimentellt).
CD155 - genen verkar ha varit föremål för positiv selektion . Proteinet har flera domäner varav domän D1 innehåller poliovirusbindningsstället. Inom denna domän är 37 aminosyror ansvariga för att binda viruset.
Poliovirus är ett enterovirus . Infektion sker via fekal-oral väg , vilket innebär att man får i sig viruset och virusreplikation sker i mag-tarmkanalen . Virus sprids i avföringen från infekterade individer. I 95 % av fallen uppträder endast en primär, övergående närvaro av viremi (virus i blodomloppet), och poliovirusinfektionen är asymtomatisk . I cirka 5 % av fallen sprids och replikerar viruset på andra platser som brunt fett , retikuloendotelvävnad och muskler . Den ihållande virusreplikationen orsakar sekundär viremi och leder till utveckling av mindre symtom som feber, huvudvärk och halsont. Paralytisk poliomyelit förekommer i mindre än 1 % av poliovirusinfektionerna. Paralytisk sjukdom uppstår när viruset kommer in i det centrala nervsystemet (CNS) och replikerar i motorneuroner i ryggmärgen , hjärnstammen eller motorisk cortex , vilket resulterar i selektiv förstörelse av motorneuroner som leder till tillfällig eller permanent förlamning . Detta är en mycket sällsynt händelse hos spädbarn som fortfarande har antikroppar mot poliovirus från sina mödrar. I sällsynta fall leder paralytisk poliomyelit till andningsstopp och död. I fall av paralytisk sjukdom observeras ofta muskelsmärta och spasmer före uppkomsten av svaghet och förlamning. Förlamning kvarstår vanligtvis från dagar till veckor före återhämtning.
I många avseenden anses den neurologiska fasen av infektionen vara en oavsiktlig avledning av den normala gastrointestinala infektionen. Mekanismerna genom vilka poliovirus kommer in i CNS är dåligt förstådda. Tre icke-ömsesidigt uteslutande hypoteser har föreslagits för att förklara dess inträde. Alla teorier kräver primär viremi. Den första hypotesen förutspår att virioner passerar direkt från blodet till det centrala nervsystemet genom att passera blod-hjärnbarriären oberoende av CD155. En andra hypotes antyder att virionerna transporteras från perifera vävnader som har badats i det viremiska blodet, till exempel muskelvävnad, till ryggmärgen genom nervbanor via retrograd axonal transport . En tredje hypotes är att viruset importeras till CNS via infekterade monocyter eller makrofager .
Poliomyelit är en sjukdom i det centrala nervsystemet. Emellertid tros CD155 finnas på ytan av de flesta eller alla mänskliga celler. Därför förklarar inte receptoruttryck varför poliovirus preferentiellt infekterar vissa vävnader. Detta tyder på att vävnadstropism bestäms efter cellulär infektion. Nyligen arbete har föreslagit att typ I- interferonsvaret (särskilt det för interferon alfa och beta) är en viktig faktor som definierar vilka typer av celler som stödjer poliovirusreplikation. Hos möss som uttrycker CD155 (genom genteknik) men som saknar typ I-interferonreceptorn, replikerar poliovirus inte bara i en utökad repertoar av vävnadstyper, utan dessa möss kan också infekteras oralt med viruset.
Undvikande av immunsystemet
Poliovirus använder två nyckelmekanismer för att undvika immunförsvaret . För det första kan det överleva de mycket sura tillstånden i magen, vilket gör att viruset kan infektera värden och spridas i hela kroppen via lymfsystemet . För det andra, eftersom det kan replikera mycket snabbt, överväldiga viruset värdorganen innan ett immunsvar kan monteras. Om detaljer ges i bifogningsfasen; poliovirus med raviner på virionytan har virusfästplatser belägna i fickor vid kanjonbaserna. Kanjonerna är för smala för åtkomst av antikroppar , så virusets fästpunkter är skyddade från värdens immunövervakning, medan resten av virionytan kan mutera för att undvika värdens immunsvar.
Individer som exponeras för poliovirus, antingen genom infektion eller genom immunisering med poliovaccin , utvecklar immunitet . Hos immunindivider finns antikroppar mot poliovirus i tonsiller och mag-tarmkanalen (specifikt IgA- antikroppar) och kan blockera poliovirusreplikation; IgG- och IgM -antikroppar mot poliovirus kan förhindra spridning av viruset till motorneuroner i centrala nervsystemet. Infektion med en serotyp av poliovirus ger inte immunitet mot de andra serotyperna; andra attacker inom samma individ är dock extremt sällsynta.
PVR transgen mus
Även om människor är de enda kända naturliga värdarna för poliovirus, kan apor infekteras experimentellt och de har länge använts för att studera poliovirus. 1990–91 utvecklades en liten djurmodell av poliomyelit av två laboratorier. Möss konstruerades för att uttrycka en human receptor till poliovirus (hPVR).
Till skillnad från vanliga möss är transgena poliovirusreceptor (TgPVR) möss mottagliga för poliovirus som injiceras intravenöst eller intramuskulärt och när de injiceras direkt i ryggmärgen eller hjärnan . Vid infektion visar TgPVR-möss tecken på förlamning som liknar poliomyelit hos människor och apor, och det centrala nervsystemet hos förlamade möss liknar histocytokemiskt de hos människor och apor. Denna musmodell av human poliovirusinfektion har visat sig vara ett ovärderligt verktyg för att förstå poliovirusbiologi och patogenicitet.
Tre distinkta typer av TgPVR-möss har studerats väl:
- I TgPVR1-möss inkorporerades transgenen som kodar för human PVR i muskromosom 4. Dessa möss uttrycker de högsta nivåerna av transgenen och den högsta känsligheten för poliovirus. TgPVR1-möss är mottagliga för poliovirus via de intraspinala, intracerebrala, intramuskulära och intravenösa vägarna, men inte genom den orala vägen.
- TgPVR21-möss har inkorporerat human PVR vid kromosom 13. Dessa möss är mindre mottagliga för poliovirusinfektion via den intracerebrala vägen, möjligen för att de uttrycker minskade nivåer av hPVR. TgPVR21-möss har visat sig vara mottagliga för poliovirusinfektion genom intranasal inokulering och kan vara användbara som en slemhinneinfektionsmodell .
- I TgPVR5-möss är den humana transgenen lokaliserad på kromosom 12. Dessa möss uppvisar de lägsta nivåerna av hPVR-uttryck och är minst mottagliga för poliovirusinfektion.
Nyligen utvecklades en fjärde TgPVR-musmodell. Dessa "cPVR " -möss bär hPVR- cDNA , som drivs av en β- aktinpromotor , och har visat sig vara mottagliga för poliovirus via intracerebrala, intramuskulära och intranasala vägar. Dessutom är dessa möss kapabla att utveckla bulbar form av polio efter intranasal inokulering.
Utvecklingen av TgPVR-musen har haft en djupgående effekt på produktionen av oralt poliovirusvaccin ( OPV). Tidigare behövde övervakning av säkerheten för OPV utföras med hjälp av apor, eftersom endast primater är mottagliga för viruset. 1999 Världshälsoorganisationen användningen av TgPVR-musen som en alternativ metod för att bedöma effektiviteten av vaccinet mot poliovirus typ-3. År 2000 godkändes musmodellen för tester av vacciner mot typ-1 och typ-2 poliovirus.
Kloning och syntes
1981 använde Racaniello och Baltimore rekombinant DNA-teknik för att generera den första infektiösa klonen av ett djur-RNA-virus, poliovirus. DNA som kodar för RNA-genomet av poliovirus infördes i odlade däggdjursceller och infektiöst poliovirus producerades. Skapandet av den infektiösa klonen drev förståelsen för poliovirusbiologi och har blivit en standardteknik som används för att studera många andra virus.
År 2002 lyckades Eckard Wimmers grupp vid Stony Brook University syntetisera poliovirus från sin kemiska kod, vilket producerade världens första syntetiska virus. Forskare omvandlade först poliovirusets publicerade RNA-sekvens, 7741 baser lång, till en DNA-sekvens, eftersom DNA var lättare att syntetisera. Korta fragment av denna DNA-sekvens erhölls via postorder och sattes ihop. Det kompletta virala genomet sammansattes sedan av ett gensyntesföretag . Nitton markörer inkorporerades i det syntetiserade DNA:t, så att det kunde särskiljas från naturligt poliovirus. Enzymer användes för att omvandla DNA tillbaka till RNA, dess naturliga tillstånd. Andra enzymer användes sedan för att översätta RNA:t till en polypeptid, som producerade funktionell viral partikel. Hela den här mödosamma processen tog två år. Det nyligen präglade syntetiska viruset injicerades i PVR-transgena möss för att avgöra om den syntetiska versionen kunde orsaka sjukdom. Det syntetiska viruset kunde replikera, infektera och orsaka förlamning eller död hos möss. Den syntetiska versionen var dock mellan 1 000 och 10 000 gånger svagare än det ursprungliga viruset, förmodligen på grund av en av de tillagda markörerna.
Modifiering för terapier
En modifiering av polioviruset, kallad PVSRIPO , testades i tidiga kliniska prövningar som en möjlig behandling för cancer. [ behöver uppdateras ]
externa länkar
- ICTVdb virus klassificering 2006
- Hem för Picornavirus (senaste uppdateringarna av arter, serotyper och föreslagna ändringar) Arkiverad 2010-11-04 på Wayback Machine
- Goodsell D. "Poliovirus och Rhinovirus" . Augusti 2001 Månadens molekyl .
- 3D makromolekylära strukturer av Polioviruset arkiverade i EM Data Bank (EMDB)
- "Humant poliovirus 1" . NCBI Taxonomy Browser . 12080.
- "Humant poliovirus 3" . NCBI Taxonomy Browser . 12086.


