Klorat

|
|

|
|
| Namn | |
|---|---|
| Andra namn Klorat(V)
|
|
| Identifierare | |
|
3D-modell ( JSmol )
|
|
| ChEBI |
|
| ChemSpider | |
| 1491 | |
|
PubChem CID
|
|
| UNII | |
| FN-nummer | 1461 |
|
CompTox Dashboard ( EPA )
|
|
|
|
|
|
| Egenskaper | |
| ClO3- _ _ | |
| Molar massa | 83,4512 |
| Strukturera | |
| Trigonal pyramidal | |
| Faror | |
| Arbetssäkerhet och hälsa (OHS/OSH): | |
|
Huvudsakliga faror
|
oxidationsmedel |
| Besläktade föreningar | |
|
Andra anjoner
|
|
|
Besläktade föreningar
|
|
|
Om inte annat anges ges data för material i standardtillstånd (vid 25 °C [77 °F], 100 kPa).
|
|
Klorat är det vanliga namnet på ClO
− 3 anjonen, vars kloratom är i +5 oxidationstillstånd . Termen kan också hänvisa till kemiska föreningar som innehåller denna anjon, med klorater som salter av klorsyra . Andra oxianjoner av klor kan benämnas "klorat" följt av en romersk siffra inom parentes som anger oxidationstillståndet för klor: t.ex. ClO −
4 - jonen som vanligtvis kallas perklorat kan också kallas klorat(VII).
Som förutspått av valensskalelektronparrepulsionsteori har kloratanjoner trigonala pyramidformade strukturer .
Klorater är kraftfulla oxidationsmedel och bör hållas borta från organiska ämnen eller lätt oxiderade material. Blandningar av kloratsalter med praktiskt taget alla brännbara material (socker, sågspån, träkol, organiska lösningsmedel, metaller, etc.) kommer lätt att deflagrera . Klorater användes en gång i stor utsträckning inom pyroteknik av denna anledning, även om deras användning har minskat på grund av deras instabilitet. De flesta pyrotekniska tillämpningar som tidigare använde klorater använder nu de mer stabila perkloraterna istället.
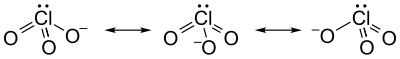
Struktur och bindning
Kloratjonen kan inte på ett tillfredsställande sätt representeras av bara en Lewis-struktur , eftersom alla Cl–O-bindningar är lika långa (1,49 Å i kaliumklorat ), och kloratomen är hypervalent . Istället betraktas det ofta som en hybrid av multipla resonansstrukturer :
Förberedelse
Laboratorium
Metallklorater kan framställas genom att tillsätta klor till heta metallhydroxider som KOH :
- 3 Cl2 + 6 KOH → 5 KCl + KClO3 + 3 H2O
I denna reaktion genomgår klor disproportionering , både reduktion och oxidation. Klor, oxidationstal 0, bildar klorid Cl − (oxidationstal −1) och klorat(V) ClO
− 3 (oxidationstal +5). Reaktionen av kalla vattenhaltiga metallhydroxider med klor ger istället kloriden och hypokloriten (oxidationstal +1). [ citat behövs ]
Industriell
Syntesen i industriell skala för natriumklorat utgår från en vattenhaltig natriumkloridlösning (saltlösning) snarare än klorgas. Om elektrolysutrustningen tillåter blandning av klor och natriumhydroxid , inträffar den ovan beskrivna disproportioneringsreaktionen. Uppvärmningen av reaktanterna till 50–70 °C utförs av den elektriska kraften som används för elektrolys . [ citat behövs ]
Naturlig förekomst
En nyligen genomförd studie har upptäckt förekomsten av naturliga kloratavlagringar runt om i världen, med relativt höga koncentrationer i torra och hypertorra områden. Kloratet mättes även i regnprover med mängden klorat liknande perklorat . Det misstänks att klorat och perklorat kan dela en gemensam naturlig bildningsmekanism och kan vara en del av klorbiogeokemins cykel. Ur en mikrobiell synvinkel kan närvaron av naturligt klorat också förklara varför det finns en mängd olika mikroorganismer som kan reducera klorat till klorid. Vidare kan utvecklingen av kloratreduktion vara ett urgammalt fenomen eftersom alla perkloratreducerande bakterier som hittills beskrivits också använder klorat som en terminal elektronacceptor. Det bör tydligt anges att inga kloratdominerande mineraler för närvarande är kända. Detta innebär att kloratanjonen endast existerar som en substitution i de kända mineralarterna, eller – så småningom – finns i de porfyllande lösningarna.
2011 avslöjade en studie av Georgia Institute of Technology närvaron av magnesiumklorat på planeten Mars.
Föreningar (salter)
Exempel på klorater inkluderar
- kaliumklorat , KClO3
- natriumklorat , NaClO3
- magnesiumklorat , Mg( ClO3 ) 2
Andra oxyanjoner
Om en romersk siffra inom parentes följer ordet "klorat", indikerar detta att oxyanjonen innehåller klor i det angivna oxidationstillståndet, nämligen:
| Vanligt namn | Aktienamn | Oxidationstillstånd | Formel |
|---|---|---|---|
| Hypoklorit | Klorat(I) | +1 | ClO − |
| Klorit | Klorat(III) | +3 |
ClO − 2 |
| Klorat | Klorat(V) | +5 |
ClO − 3 |
| Perklorat | Klorat (VII) | +7 |
ClO - 4 |
Med denna konvention betyder "klorat" vilken som helst kloroxianjon. Vanligtvis hänvisar "klorat" endast till klor i +5 oxidationstillstånd.
Giftighet
Klorater är relativt giftiga, även om de i allmänhet bildar ofarliga klorider vid reduktion.
externa länkar
- . Encyclopædia Britannica . Vol. 6 (11:e upplagan). 1911. sid. 254.