Metylentrifenylfosforan

|
|

|
|
| Namn | |
|---|---|
|
Föredraget IUPAC-namn
Metylidentri(fenyl)fosfan |
|
| Identifierare | |
|
3D-modell ( JSmol )
|
|
| ChemSpider | |
|
PubChem CID
|
|
| UNII | |
|
CompTox Dashboard ( EPA )
|
|
|
|
|
|
| Egenskaper | |
| C19H17P _ _ _ _ | |
| Utseende | gul fast substans |
| Densitet | 1,19 g/cm 3 |
| bryta ned | |
| Löslighet | THF |
|
Om inte annat anges ges data för material i standardtillstånd (vid 25 °C [77 °F], 100 kPa).
|
|
Metylentrifenylfosforan är en organofosforförening med formeln Ph 3 PCH 2 . Det är föräldramedlemmen till fosforylider, populärt kända som Wittig-reagenser . Det är en mycket polär, mycket grundläggande art.
Förberedelse och användning
Metylentrifenylfosforan framställs av metyltrifenylfosfoniumbromid genom dess deprotonering med användning av en stark bas som butyllitium :
- Ph 3 PCH 3 Br + BuLi → Ph 3 PCH 2 + LiBr + BuH
Fosforanen är i allmänhet inte isolerad utan används istället in situ. Det uppskattade pKa för denna kolsyra är nära 15. Kalium-tert-butoxid har använts i stället för butyllitium . Natriumamid har också använts som bas.
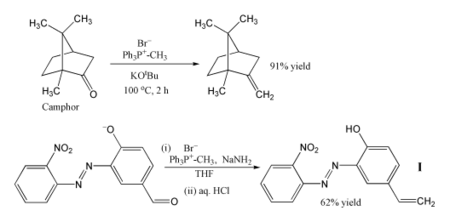
Metylentrifenylfosforan används för att ersätta syrecentra i aldehyder och ketoner med en metylengrupp, dvs en metylenering :
- R2CO + Ph3PCH2 → R2C = CH2 + Ph3PO _ _ _ _
Den fosforhaltiga produkten är trifenylfosfinoxid .
Strukturera
Kristallografisk karakterisering av den färglösa yliden avslöjar att fosforatomen är ungefär tetraedrisk. PCH 2 -centrum är plant och P=CH2 - avståndet är 1,661 Å, vilket är mycket kortare än P-Ph-avstånden (1,823 Å). Föreningen beskrivs vanligtvis som en kombination av två resonansstrukturer :
- Ph 3 P + CH 2 − ↔ Ph 3 P=CH 2
Används
Metylentrifenylfosforan har blivit ett standardverktyg för syntetiska organiska kemister.
Relaterade reagenser
- ^ Wittig, Georg; Schoellkopf, U. (1960). "Metylencyklohexan". Organiska synteser . 40 : 66. doi : 10.15227/orgsyn.040.0066 .
- ^ Ling-Chung, Sim; Sales, Keith D.; Utley, James HP (1990). "Mätning av pKa- värden för fosfoniumsalter via kinetiken för protonöverföring till en elektrogenererad bas". Journal of the Chemical Society, Chemical Communications (9): 662. doi : 10.1039/C39900000662 .
- ^ Fitjer, L.; Quabeck, U. Synthetic Communications 1985 , 15(10) , 855–864.
-
^
FA Bottino, G. Di Pasquale, A. Pollicino, A. Recca och DT Clark (1990). "Syntes av 2-(2-hydroxifenyl)-2H-bensotriazolmonomerer och studier av ytfotostabilisering av de relaterade sampolymererna". Makromolekyler . 23 (10): 2662–2666. Bibcode : 1990MaMol..23.2662B . doi : 10.1021/ma00212a011 .
{{ citera tidskrift }}: CS1 underhåll: flera namn: lista över författare ( länk ) - ^ Bart, JCJ (1969). "Struktur av den icke-stabiliserade fosfoniumyliden metylentrifenylfosforan". Journal of the Chemical Society B . 1969 : 350–365. doi : 10.1039/J29690000350 .
- ^ BE Maryanoff & AB Reitz (1989). "Wittig-olefineringsreaktionen och modifieringar som involverar fosforylstabiliserade karbanjoner. Stereokemi, mekanism och utvalda syntetiska aspekter". Chem. Upp. 89 (4): 863–927. doi : 10.1021/cr00094a007 .