Litet tumörantigen
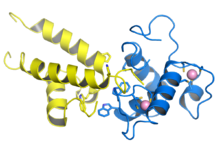
Det lilla tumörantigenet (även kallat det lilla T-antigenet och förkortat STag eller ST ) är ett protein som kodas i genomen av polyomavirus , som är små dubbelsträngade DNA-virus . STag uttrycks tidigt i den infektiösa cykeln och är vanligtvis inte avgörande för viral proliferation, även om det i de flesta polyomavirus förbättrar replikationseffektiviteten. STag-proteinet uttrycks från en gen som överlappar det stora tumörantigenet (LTag) så att de två proteinerna delar en N-terminal DnaJ -liknande domän men har distinkta C-terminala regioner. STag är känt för att interagera med värdcellsproteiner , framför allt proteinfosfatas 2A (PP2A), och kan aktivera uttrycket av cellulära proteiner associerade med cellcykelövergången till S- fas . I vissa polyomavirus - såsom det välstuderade SV40 , som naturligt infekterar apor - kan STag inte inducera neoplastisk transformation i värdcellen på egen hand, men dess närvaro kan öka transformationseffektiviteten hos LTag. I andra polyomavirus, såsom Merkel cell polyomavirus , som orsakar Merkel cell carcinom hos människor, verkar STag vara viktigt för replikation och vara ett onkoprotein i sig.
Struktur och uttryck

Generna för både det lilla och det stora tumörantigenet kodas i den "tidiga regionen" av polyomavirusgenomet, så kallat eftersom denna region av genomet uttrycks tidigt i den infektiösa processen. (Den "sena regionen" innehåller gener som kodar för de virala kapsidproteinerna .) Den tidiga regionen innehåller vanligtvis minst två gener och transkriberas som ett enda budbärar-RNA bearbetat genom alternativ splitsning . LTag-genen kodas vanligtvis i två exoner , varav den första överlappar genen för STag (och ibland även andra tumörantigener, såsom det murina polyomavirusets mellersta tumörantigenet ). Polyomavirus STag-proteiner är vanligtvis cirka 170-200 rester långa och består av två distinkta regioner som ett resultat av denna genetiska kodning. STag och LTag delar en gemensam N-terminal domän som kallas J-domänen, som är cirka 80-90 rester lång, har homologi med DnaJ -proteiner och fungerar som en molekylär chaperon .
Den C-terminala delen av STag-proteinet skiljer sig från LTag men delar ytterligare ~100 rester med mellantumörantigen i de virus som uttrycker det, såsom murint polyomavirus . Den C-terminala regionen av STag innehåller en proteinfosfatas 2A- bindande region, följt i däggdjurspolyomavirus av en metalljonbindande region vid C-terminalen med konserverade cysteininnehållande sekvensmotiv . Dessa tros binda zink i SV40 STag och ge förbättrad proteinstabilitet , men i Merkel cell polyomavirus STag har de rapporterats binda järn-svavelkluster . Bland polyomavirus som infekterar fåglar - klassificerade i släktet Gammapolyomavirus - finns de konserverade cysteinerna som karaktäriserar dessa metallbindande regioner inte närvarande och det finns ingen detekterbar sekvenshomologi mellan fågel- och däggdjurs STag C-termini.
Fungera
Den exakta funktionella rollen för STag varierar mellan polyomavirus. I SV40- och JC-virus krävs inte STag för viral proliferation, men förbättrar effektiviteten. I SV40 har STag en liknande roll i cellulär transformation. I Merkel cell polyomavirus verkar det spela en betydande roll i onkogenes , en funktion som huvudsakligen utförs av LTag i andra polyomavirus. Där tumörantigenernas subcellulära lokalisering har karakteriserats, är STag vanligtvis lokaliserad i cytoplasman .
Viral replikation
I de flesta välstuderade polyomavirus förbättrar STag effektiviteten av viral proliferation men är inte nödvändigt . SV40 och murina polyomavirus STags verkar ha en roll för att främja värdcellsuttryck av gener under kontroll av vissa typer av promotorer . Denna funktion förmedlas av J-domänen, förmodligen indirekt eftersom STag inte har någon egen DNA-bindande förmåga. Både STag och LTag interagerar genom sina J-domäner med Hsc70 för att öka dess ATPas- aktivitet.
Effekter på cellcykeln
Eftersom polyomavirusgenomreplikation är beroende av värdcellens DNA-replikationsmaskineri måste cellen vara i S-fas (den del av cellcykeln där värdcellens genom normalt replikeras) för att tillhandahålla det nödvändiga molekylära maskineriet för viralt DNA replikering. Virala proteiner främjar därför dysreglering av cellcykeln och inträde i S-fasen. Denna funktion tillhandahålls vanligtvis primärt av LTag genom dess interaktioner med retinoblastomprotein och p53 .
STag bidrar till denna process genom sin interaktion med proteinfosfatas 2A (PP2A). Den aktiva formen av PP2A består av en heterotrimer sammansättning av tre subenheter. Röntgenkristallografi av STag-PP2A- proteinkomplexet visar att STag ersätter en subenhet i komplexet och därigenom inaktiverar den.
Cellulär transformation
Vissa, men inte alla, polyomavirus är onkovirus som kan inducera neoplastisk transformation i vissa celler. I onkogena polyomavirus är tumörantigenerna ansvariga för transformationsaktiviteten, även om de exakta molekylära mekanismerna varierar från ett virus till ett annat. STag är vanligtvis inte kapabel att inducera dessa effekter på egen hand, men ökar effektiviteten av transformationen eller är ibland en nödvändig komponent utöver LTag. I de flesta polyomavirus medieras STags effekt på transformation genom dess interaktion med PP2A.
Distinkta funktioner i Merkel cell polyomavirus
Merkel cell polyomavirus (MCPyV) är ett virus som orsakas av en sällsynt och aggressiv human hudcancer som kallas Merkel cell carcinoma . MCPyV genetiskt material hittas ofta integrerat i tumörcellsgenomet, vanligtvis med mutationer i tumörantigengenerna som upphäver helikasaktiviteten hos LTag, som krävs för normal viral replikation. I MCPyV är STag, snarare än LTag, det primära onkoproteinet , finns i Merkel-cellkarcinom oftare än LTag, krävs för tumörtillväxt och har ytterligare pro-transformationseffekter oberoende av dess PP2A-bindande aktivitet. MCPyV STag tros inducera dysreglering av cap-beroende translation genom att främja fosforylering av eukaryotisk translationsinitieringsfaktor 4E-BP1 . In vivo- studier i gnagarmodeller tyder på att MCPyV STag ensamt kan vara tillräckligt för att driva transformation.

