Lewis-syrakatalys
I Lewis-syrakatalys av organiska reaktioner fungerar en metallbaserad Lewis-syra som en elektronparacceptor för att öka reaktiviteten hos ett substrat. Vanliga Lewis-syrakatalysatorer är baserade på huvudgruppmetaller såsom aluminium , bor , kisel och tenn , såväl som många tidiga ( titan , zirkonium ) och sena ( järn , koppar , zink ) d-blockmetaller. Metallatomen bildar en addukt med en ensam-par-bärande elektronegativ atom i substratet, såsom syre (både sp 2 eller sp 3 ), kväve , svavel och halogener . Komplexbildningen har partiell laddningsöverföringskaraktär och gör den ensamma pardonatorn effektivt mer elektronegativ, vilket aktiverar substratet mot nukleofil attack, heterolytisk bindningsklyvning eller cykloaddition med 1,3-diener och 1,3-dipoler.
Många klassiska reaktioner som involverar bildning av kol-kol eller kol-heteroatombindningar kan katalyseras av Lewis-syror. Exempel inkluderar Friedel-Crafts-reaktionen , aldolreaktionen och olika pericykliska processer som fortskrider långsamt vid rumstemperatur, såsom Diels-Alder-reaktionen och ene-reaktionen . Förutom att påskynda reaktionerna kan Lewis-syrakatalysatorer påtvinga regioselektivitet och stereoselektivitet i många fall.
Tidig utveckling av Lewis-syrareagenser fokuserade på lättillgängliga föreningar som TiCl 4 , BF 3 , SnCl 4 , och AlCl 3 . Under årens lopp har mångsidiga katalysatorer som bär ligander utformade för specifika tillämpningar underlättat förbättringar i både reaktivitet och selektivitet för Lewis-syrakatalyserade reaktioner. På senare tid har Lewis-syrakatalysatorer med kirala ligander blivit en viktig klass av verktyg för asymmetrisk katalys .
Utmaningar i utvecklingen av Lewis-syrakatalys inkluderar ineffektiv katalysatoromsättning (orsakad av katalysatoraffinitet för produkten) och det frekventa kravet på tvåpunktsbindning för stereoselektivitet, vilket ofta kräver användning av hjälpgrupper.
Mekanism
I reaktioner med polära mekanismer involverar Lewis-syrakatalys ofta bindning av katalysatorn till Lewis-basiska heteroatomer och avlägsnande av elektrontäthet, vilket i sin tur underlättar heterolytisk bindningsklyvning (i fallet med Friedel-Crafts-reaktion) eller direkt aktiverar substratet mot nukleofil attack ( i fallet med karbonyladditionsreaktioner ). Dikotomien kan få viktiga konsekvenser i vissa reaktioner, som i fallet med Lewis-syrabefrämjade acetalsubstitutionsreaktioner, där S N 1 och S N 2 mekanismer som visas nedan kan ge olika stereokemiska resultat. Genom att studera produktförhållandet i ett bicykliskt system visade Danmark och kollegor att båda mekanismerna kunde vara operativa beroende på denticitet och R'-gruppens identitet.

I Diels-Alder och 1,3-dipolära cykloadditionsreaktioner sänker Lewis-syror LUMO -energin för dienofilen respektive dipolarfilen, vilket gör den mer reaktiv mot dien eller dipol.
Lewis-syrakatalys med karbonylhaltiga substrat
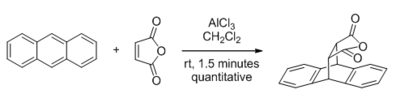
Bland de typer av reaktioner som kan katalyseras av Lewis-syror har de med karbonylhaltiga substrat fått störst uppmärksamhet. Den första stora upptäckten i detta område var 1960, när Yates och Eaton rapporterade den betydande accelerationen av Diels-Alder-reaktionen av AlCl 3 när maleinsyraanhydrid är dienofilen.
Tidiga teoretiska studier som var beroende av gränsomloppsanalys fastställde att Lewis-syrakatalys fungerar via sänkning av dienofilens LUMO-energi. Nyligen genomförda studier har dock visat att denna logik bakom Lewis-syrakatalyserade Diels-Alder-reaktioner är felaktig. Det har visat sig att Lewis-syror accelererar Diels-Alder-reaktionen genom att minska den destabiliserande steriska Pauli-repulsionen mellan den interagerande dien och dienofilen och inte genom att sänka energin hos dienofilens LUMO och följaktligen förbättra den normala elektronbegärans orbitala interaktion. Lewis-syran binder via en donator-acceptor-interaktion till dienofilen och via den mekanismen polariserar den ockuperade orbitala tätheten bort från dienofilens reaktiva C=C-dubbelbindning mot Lewis-syran. Denna minskade ockuperade orbitala täthet på C=C-dubbelbindningen hos dienofilen kommer i sin tur att ingå i en mindre repulsiv sluten-skal-sluten-skal-orbital interaktion med den inkommande dienen, vilket minskar den destabiliserande steriska Pauli-repulsionen och sänker därmed Diels- Alreaktionsbarriär. Dessutom ökar Lewis-syrakatalysatorn också asynkroniciteten för Diels-Alder-reaktionen, vilket gör den upptagna π-orbitalen som ligger på C=C-dubbelbindningen av dienofilen asymmetrisk. Som ett resultat leder denna förbättrade asynkronicitet till en extra minskning av den destabiliserande steriska Pauli-repulsionen såväl som ett minskande tryck på reaktanterna att deformeras, med andra ord, det minskade den destabiliserande aktiveringsbelastningen (även känd som distorsionsenergi). Denna fungerande katalytiska mekanism är känd som Pauli-sänkande katalys , som är verksam i en mängd olika organiska reaktioner.
Den ursprungliga motiveringen bakom Lewis-syrakatalyserade Diels-Alder-reaktioner är felaktig, för förutom att sänka energin hos dienofilens LUMO, sänker Lewis-syran också energin hos dienofilens HOMO och ökar därmed det omvända elektronbehovet LUMO-HOMO orbitalenergin glipa. Sålunda stärker faktiskt Lewis-syrakatalysatorer den normala elektronbegäran-orbitalinteraktionen genom att sänka LUMO för dienofilen, men de försvagar samtidigt den omvända elektronbegäranorbitalinteraktionen genom att också sänka energin hos dienofilens HOMO. Dessa två motverkande fenomen upphäver varandra effektivt, vilket resulterar i nästan oförändrade orbitala interaktioner jämfört med motsvarande okatalyserade Diels-Alder-reaktioner och gör att detta inte är den aktiva mekanismen bakom Lewis-syrakatalyserade Diels-Alder-reaktioner.
Förutom hastighetsacceleration uppvisar Lewis-syrakatalyserade reaktioner ibland ökad stereoselektivitet, vilket stimulerade utvecklingen av stereoinduktionsmodeller. Modellerna har sina rötter i kunskap om strukturerna hos Lewis-syra-karbonylkomplex som, genom årtionden av forskning inom teoretiska beräkningar , NMR - spektroskopi och röntgenkristallografi , var ganska fast etablerade i början av 1990-talet:
- σ-komplexbildning: Komplexet där Lewis-syran interagerar med karbonylföreningen genom en σ-bindning med det ensamma syreparet är både termodynamiskt gynnat och katalytiskt relevant. Flera övergångsmetallkomplex av aldehyder och ketoner har karakteriserats kristallografiskt.
- Böjd geometri: Metall-syre-kolbindningsvinkeln är mindre än 180°, och metallen är synad till den mindre substituenten, såvida den inte påverkas av en kelatbildande grupp på den större substituenten.
- En s-trans- preferens för α,β-omättade föreningar.
Addition och konjugataddition till karbonylföreningar
Mukaiyama aldol-reaktionen och Sakurai-reaktionen hänvisar till tillsatsen av silylenoletrar respektive allylsilaner till karbonylföreningar. Endast under Lewis-syrakatalys sker dessa reaktioner under syntetiskt användbara betingelser. Acykliska övergångstillstånd tros fungera i båda reaktionerna för antingen 1,2- eller 1,4-addition, och steriska faktorer styr stereoselektiviteten. Detta står i kontrast till det stela Zimmerman-Traxler cykliska övergångstillståndet som har blivit allmänt accepterat för aldolreaktionen med litium, bor och titan enolater . Som en konsekvens översätter dubbelbindningsgeometrin i silylenoletern eller allylsilanen inte bra till produktstereokemi. En modell för Sakurai 1,2-tillägget, föreslagen av Kumada, presenteras i schemat nedan; syn - diastereomeren är övervägande när (E) -silanen används, och även något favoriserad när (Z) -silanen används. En liknande analys av Heathcock förklarar det faktum att det med enkla substrat i huvudsak inte finns någon diastereoselektivitet för den intermolekylära Mukaiyama aldol-reaktionen.
Lewis-syrakatalysatorn spelar en roll i stereoselektiviteten när aldehyden kan kelateras på metallcentrumet och bilda en stel cyklisk mellanprodukt. Det stereokemiska resultatet överensstämmer då med närmandet av den nukleofila antigen till den mer skrymmande substituenten på ringen.
Diels-Alder reaktion
Lewis-syror som ZnCl 2 , BF 3 , SnCl 4 , AlCl 3 och MeAlCl 2 kan katalysera både normala och omvända elektronbehov Diels-Alder-reaktioner . Förbättringen av hastigheten är ofta dramatisk, och regioselektiviteten mot orto- eller paraliknande produkter förbättras ofta, vilket visas i reaktionen mellan isopren och metylakrylat .
Den katalyserade Diels-Alder-reaktionen tros vara samordnad . En beräkningsstudie på B3LYP/6-31G(d)-nivån har emellertid visat att övergångstillståndet för den BF3 -katalyserade Diels-Alder-reaktionen mellan propenal och 1,3-butadien är mer asynkron än den för den termiska reaktionen. – bindningen längre från karbonylgruppen bildas före den andra bindningen.
Ene reaktion
Karbonyl -en-reaktionen katalyseras nästan alltid av Lewis-syror i syntetiska tillämpningar. En stegvis eller en i stort sett asynkron mekanism har föreslagits för den katalyserade reaktionen baserat på kinetiska isotopeffektstudier . Icke desto mindre anropas cykliska övergångstillstånd ofta för att tolka diastereoselektivitet. I en nyanserad granskning i början av 1990-talet föreslog Mikami och kollegor ett sent, stolliknande övergångstillstånd, som skulle kunna rationalisera många observerade stereokemiska resultat, inklusive rollen av sterisk bulk i diastereoselektivitet:
På senare tid utförde dock samma grupp HF/6-31G*-beräkningar på tenn- eller aluminium-Lewis-syrakatalyserade en-reaktioner. Med hänvisning till att metylgloxylat kelerar tenn Lewis-syror men inte aluminium, åberopade de ett tidigt, kuvertliknande övergångstillstånd och rationaliserade det divergerande stereokemiska resultatet av ene-reaktionen mellan ( E) -2-buten och metylglyoxylat.
Tillämpning i syntes
Lewis-syrakatalyserade karbonyladditionsreaktioner används rutinmässigt för att bilda kol-kolbindningar i naturlig produktsyntes . De två första reaktionerna nedan är från synteserna av (+)-lykoflexin respektive zaragozic acid C, vilka är direkta tillämpningar av Sakurai- och Mukaiyama-reaktioner. Den tredje reaktionen, på väg till (+)-fawcettimin, är en Lewis-syrakatalyserad cyklopropanöppning som är analog med en Mukaiyama- Michael-reaktion .
Diels-Alder-reaktionen som katalyseras eller främjas av Lewis-syror är en kraftfull och allmänt använd metod i syntes av naturliga produkter för att uppnå komplexitet i byggnadsställningar i ett enda steg med stereokemisk kontroll. De två reaktionerna som visas nedan är en intramolekylär Diels-Alder-reaktion mot (−)-fusarisetin A respektive en intermolekylär hetero-Diels-Alder-reaktion mot (−)-epibatidin.
I Friedel-Crafts- alkylering främjar en Lewis-syra - vanligtvis ett enkelt metallhalidsalt - heterolytisk klyvning av en kol-halogenbindning i en alkylhalogenid och genererar en karbokatjon , som genomgår elektrofil aromatisk substitution . Även om den är mycket användbar vid syntes, lider reaktionen ofta av sidoreaktioner som uppstår från karbokatjonomlagring , alkylmigrering och överalkylering. Likaså i Friedel-Crafts acylering, hjälper en Lewis-syra till genereringen av en acyliumjon från en syraklorid (eller ibland syraanhydrid). Även om acyliumjonen ofta antas vara den aktiva mellanprodukten, finns det bevis för att den protonerade acyliumdikeringen är den aktiva elektrofilen som genomgår efterföljande elektrofil aromatisk substitution.
Viktiga varianter av Friedel-Crafts-reaktionen inkluderar klormetylering (med formaldehyd och HCl), formylering (med HCl och CO eller CN − ) och acylering med en nitril som acylkälla. Den nitrilbaserade acyleringen är särskilt användbar eftersom den tillåter direkt orto-acylering av anilin utan att skydda amingruppen. En kombination av en svag och en stark Lewis-syra är nödvändig för att reaktionen ska fortsätta, genom mekanismen som visas nedan. Med hjälp av denna mekanism, och utrustade med kunskap om att galliumtrihalider är bland de starkaste Lewis-syrorna, kunde processkemister på Merck utveckla mycket effektiva förhållanden för detta tillstånd mot en läkemedelskandidat.
Asymmetrisk Lewis-syrakatalys
Vanliga kirala ligander
Asymmetrisk katalys av Lewis-syror förlitar sig på katalysatorer med kirala ligander koordinerade till metallcentrum. Under årens lopp har ett litet antal kirala ligandställningar stått ut som att ha "privilegierade" katalytiska egenskaper som är lämpliga för ett brett spektrum av tillämpningar, ofta av orelaterade mekanismer. Aktuella forskningsansträngningar inom asymmetrisk Lewis-syrakatalys använder eller modifierar mest dessa ligander snarare än att skapa nya byggnadsställningar de novo . De "privilegierade" byggnadsställningarna delar några gemensamma drag, inklusive kemisk stabilitet och relativt enkel utarbetning. Majoriteten av ställningarna är flertandad . De flesta av dem har också hög ställningsstyvhet i liganden. Flera av dem har ganska mogna stereoinduktionsmodeller tillgängliga. Några "privilegierade" byggnadsställningar, som identifierats av Jacobsen och Zhou, introduceras nedan.
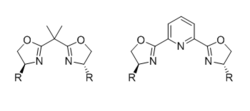
Bisoxazoliner (BOX)
De vanligaste kirala bisoxazolinliganderna (BOX) består av två identiska kirala oxazolingrupper, ersatta av en skrymmande grupp vid 4-positionerna, förenade med en länk. Liganden är tvåtandad när länken är en enda kolenhet, men är tretandad (vanligen meridional) när länken bär en ytterligare koordinerande atom, såsom ett pyridin-kväve i fallet med PyBOX-ligander. Effekten av liganddenticitet och aktiv mellanliggande geometri på det stereokemiska resultatet har granskats noggrant.
Många bidentat BOX-baserade Lewis-syrakatalyserade reaktioner är baserade på koppar(II)-katalysatorer med substrat som är lämpliga för tvåpunktsbindning. Det stereokemiska resultatet överensstämmer med en vriden kvadratisk plan mellanprodukt som föreslogs baserat på relaterade kristallstrukturer. Substituenten i oxazolinens 4-position blockerar en enantiotopisk yta av substratet, vilket leder till enantioselektivitet. Detta visas i följande av aldol -typ, men är tillämpbar på en mängd olika reaktioner såsom reaktioner av Mannich -typ, ene-reaktion , Michael addition , Nazarov-cyklisering och hetero- Diels-Alder-reaktion .
Å andra sidan skulle tvåpunktsbindning på en Lewis-syra som bär den meridionalt tridentata PyBOX-liganden resultera i ett fyrkantigt pyramidiskt komplex. En studie med bensyloxiacetaldehyd som elektrofil visade att det stereokemiska resultatet överensstämmer med karbonylsyrebindningen ekvatorialt och etersyrebindningen axiellt.
BINAP
Utvecklad av Noyori, BINAP (2,2'-difenylfosfino-1,1'-binaftyl) är en familj av kirala difosfinligander med två triarylfosfindelar installerade på en binaftalenryggrad. BINAP kelerar på en metall (vanligtvis en sen övergångsmetall) för att bilda ett C2 - symmetriskt komplex. Som visas nedan i strukturen av ett (R) -BINAP ruteniumkomplex , bland de fyra återstående koordinationsplatserna på en oktaedrisk metallcentrum är de två ekvatoriala platserna (lila) starkt påverkade av de ekvatoriala fenylgrupperna, medan de två axiella platserna (gröna) påverkas av de axiella fenylgrupperna.
Baserat på strukturen har modeller för den observerade enantioselektiviteten i många BINAP-baserade Lewis-syrakatalyserade reaktioner föreslagits. Till exempel, i den palladiumkatalyserade enantioselektiva Diels-Alder-reaktionen som visas nedan, tros dienofilen koordinera metallcentrum vid ekvatorställena. Således blockerar den ekvatoriala fenylgruppen på fosfor Si -ytan , vilket resulterar i utmärkt enantioselektivitet. En mycket liknande modell användes för att rationalisera resultatet av en nickelkatalyserad asymmetrisk enolatalkyleringsreaktion, där substratet också bär ett hjälpmedel som gör att det kan kelera på metallen. Å andra sidan tros en koppar(I)-katalyserad hetero-enreaktion fortgå genom en tetraedrisk mellanprodukt, vilket erbjuder ett alternativt sätt för stereoinduktion genom att ändra metallcentrum.
BINOL
BINOL (1,1'-binaftyl-2,2'-diol) används vanligtvis tillsammans med oxofila Lewis-syrametaller såsom aluminium, titan, zirkonium och olika sällsynta jordartsmetaller. I de fall där BINOL i sig inte tillhandahåller idealisk enantioselektiv kontroll, kan den lätt utvecklas genom substitution vid 3,3'-positionerna (via litiering ) och 6,6'-positionerna (via 6,6'-dibromidföreningen framställd av elektrofil aromatisk utbyte ) för att modulera sterisk bulk och elektroniska egenskaper. Till exempel har aluminiumkatalysatorer baserade på skrymmande 3,3'-disilylsubstituerad BINOL utvecklats som tidiga exempel på katalytisk asymmetrisk hetero- Diels-Alder-reaktion och Claisen-omlagring , samtidigt som införandet av elektronbortdragande grupper vid 6,6'-positionerna var avgörande för att öka Lewis-surheten, och därmed den katalytiska aktiviteten, hos zirkonium(IV)-katalysatorer mot en reaktion av Mannich -typ. Hittills har dock ingen modell för de avgörande faktorerna som styr BINOL-riktad stereoinduktion varit allmänt accepterad.
TADDOL
TADDOL står för tetraaryl-1,3-dioxolan-4,5-dimetanol. Den breda tillämpningen av titan TADDOLate-katalysatorer mot karbonyltillsatser och cykloadditioner har introducerats av Seebach och medarbetare och har sammanfattats grundligt i en nyanserad översyn, där en fungerande stereoinduktionsmodell som överensstämde med den observerade selektiviteten i en mängd olika reaktioner lades fram. framåt, trots avsaknaden av en tydlig bild av mekanismen.
Ansökningar
Lewis-syrakatalys har använts i asymmetri-inställningssteget för syntes av många naturliga produkter . Den första reaktionen som visas nedan, från syntesen av taxanskelett , använder en kopparbaserad katalysator uppburen av en kiral fosforamiditligand för en konjugatkarbonyladditionsreaktion. Den andra reaktionen, från syntesen av ent - hyperforin , använder en järn-PyBOX-katalysator för en asymmetrisk Diels-Alder-reaktion .