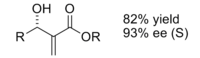Chiral Lewis-syra
Chiral Lewis-syror (CLA) är en typ av Lewis- syrakatalysator . Dessa syror påverkar substratets kiralitet när de reagerar med det. I sådana reaktioner gynnar syntes bildningen av en specifik enantiomer eller diastereomer . Metoden är en enantioselektiv asymmetrisk syntesreaktion . Eftersom de påverkar kiraliteten producerar de optiskt aktiva produkter från optiskt inaktiva eller blandade utgångsmaterial. Denna typ av preferensbildning av en enantiomer eller diastereomer framför den andra är formellt känd som asymmetrisk induktion . I denna typ av Lewis-syra är den elektronaccepterande atomen vanligtvis en metall, såsom indium , zink , litium , aluminium , titan eller bor . De chiralförändrande liganderna som används för att syntetisera dessa syror har ofta multipla Lewis-basiska ställen (ofta en diol- eller en dikvävestruktur) som tillåter bildningen av en ringstruktur som involverar metallatomen.
Achiral Lewis-syror har använts i årtionden för att främja syntesen av racemiska blandningar i otaliga olika reaktioner. Sedan 1960-talet har kemister använt Chiral Lewis-syror för att inducera enantioselektiva reaktioner. Detta är användbart när den önskade produkten är en specifik enantiomer, vilket är vanligt vid läkemedelssyntes. Vanliga reaktionstyper inkluderar Diels-Alder- reaktioner, ene-reaktionen , [2+2] cykloadditionsreaktioner , hydrocyanering av aldehyder och framför allt Sharpless epoxidationer .
Teori
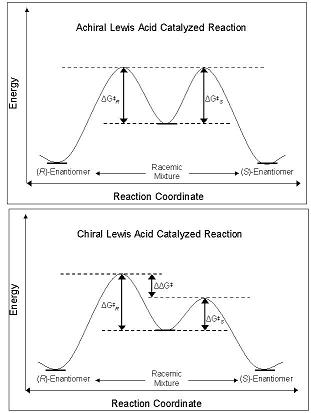
Enantioselektiviteten hos CLA härrör från deras förmåga att störa den fria energibarriären tillsammans med reaktionskoordinatvägen som leder till antingen R- eller S -enantiomeren. Grundtillståndsdiastereomerer och enantiomerer har samma energi i grundtillståndet, och när de reageras med en akiral Lewis-syra har deras diastereomera mellanprodukter, övergångstillstånd och produkter lika mycket energi. Detta leder till produktion av racemiska blandningar . Men när en CLA används i samma reaktion är den energetiska barriären för bildning av en diastereomer mindre än den för en annan; reaktionen är under kinetisk kontroll . Om skillnaden i energibarriärerna mellan de diastereomera övergångstillstånden är av tillräcklig storlek, observeras ett högt enantiomert överskott av en isomer.
Asymmetrisk syntes
Diels-Alder reaktion
Diels-Alder-reaktioner inträffar mellan en konjugerad dien och en alken (allmänt känd som dienofilen ). Denna cykloadditionsprocess möjliggör stereoselektiv bildning av cyklohexenringar som kan ha så många som fyra sammanhängande stereogena centra.
Diels-Alder-reaktioner kan leda till bildandet av en mängd olika strukturella isomerer och stereoisomerer. Molecular orbital theory anser att endoövergångstillståndet, istället för exoövergångstillståndet, gynnas (endoadditionsregeln). Dessutom har förstärkta sekundära orbitala interaktioner postulerats som källan till förbättrad endo-diastereoselektion.
Vanligtvis används CLA för att aktivera dienofilen. En typisk CLA-katalysator är härledd från ett Mg 2+ -centrum som gjorts kiralt genom fästning av en binol -fosfatester. CLA har applicerats på ett antal intramolekylära Diels-Alder-reaktioner.
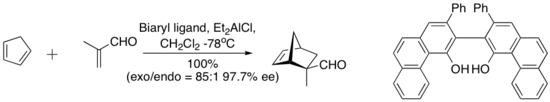
Ett komplex som härrör från dietylaluminiumklorid och en "välvd" biarylligand nedan katalyserar den enantioselektiva Diels-Alder-reaktionen mellan cyklopentadien och metakrolein. Den kirala liganden utvinns kvantitativt genom silikagelkromatografi .
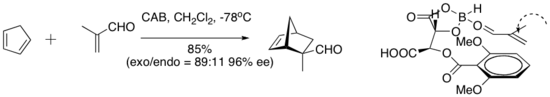
Det kirala (acyloxi) boran (CAB) komplexet är effektivt för att katalysera ett antal aldehyd Diels-Alder reaktioner. NMR-spektroskopiska experiment har indikerat närhet till aldehyden och arylringen. Pi-stapling mellan arylgruppen och aldehyden har föreslagits som en organisatorisk egenskap som ger hög enantioselektivitet till cykloadditionen.
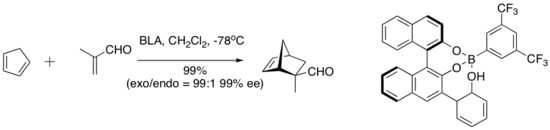
Bronsted-syraassisterad kiral Lewis-syra (BLA) katalyserar ett antal dien-aldehyd-cykloadditionsreaktioner.
Aldol reaktion
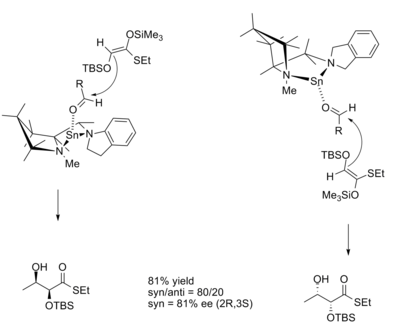
I aldolreaktionen dikteras produktens diastereoselektivitet ofta av enolatets geometri. Zimmerman -Traxler-modellen förutspår att Z- enolaten kommer att ge syn- produkter och att E-enolaten kommer att ge antiprodukter . Reaktioner katalyserade av tennbaserade CLA tillåter produkter att avvika från detta mönster.
Övergångsstrukturerna för reaktioner med både R- och S-katalysatorenantiomererna är :
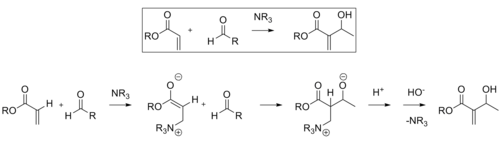
Baylis-Hillman reaktion
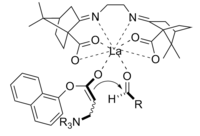
Baylis -Hillman-reaktionen är en väg för CC-bindning mellan en alfa, beta-omättad karbonyl och en aldehyd , vilket kräver en nukleofil katalysator, vanligtvis en tertiär amin , för en Michael-typ addition och eliminering. Stereoselektiviteten för dessa reaktioner är vanligtvis dålig. Lantan (III)-innehållande CLA har visats förbättra stereoselektiviteten. På liknande sätt kan en kiral amin också användas för att uppnå stereoselektivitet.
Produkten som erhölls genom reaktionen med användning av den kirala katalysatorn erhölls i gott utbyte med utmärkt enantioselektivitet.
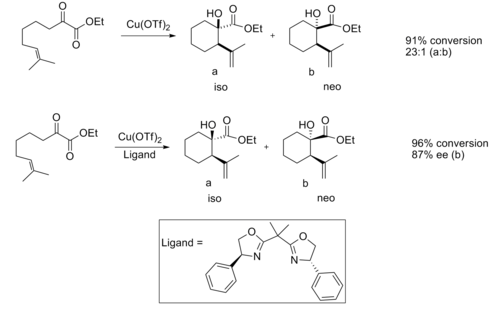
Ene reaktion
Kirala Lewis-syror har visat sig användbara i ene-reaktionen . När den katalyseras av en akiral Lewis-syra ger reaktionen normalt god diastereoselektivitet.
God enantioselektivitet har observerats när en kiral Lewis-syrakatalysator används.
Enantioselektiviteten tros bero på de steriska interaktionerna mellan metyl- och fenylgruppen , vilket gör övergångsstrukturen för isoprodukten avsevärt mer gynnsam.
Achiral Lewis-syror i stereoselektiv syntes
I vissa fall kan en akiral Lewis-syra ge god stereoselektivitet. Kimura et al. visade den regio- och diastereoselektiva kopplingen av 1,3- diener med aldehyder med användning av en nickelkatalysator .