Kinin total syntes
Den totala syntesen av kinin , ett naturligt förekommande läkemedel mot malaria , utvecklades under en 150-årsperiod. Utvecklingen av syntetiskt kinin anses vara en milstolpe inom organisk kemi även om det aldrig har producerats industriellt som ett substitut för naturligt förekommande kinin. Ämnet har också uppmärksammats med viss kontrovers: Gilbert Stork publicerade den första stereoselektiva totalsyntesen av kinin 2001, samtidigt som han kastade tvivel på det tidigare påståendet av Robert Burns Woodward och William Doering 1944, och hävdade att de sista stegen som krävs för att konvertera deras sista syntetisk mellanprodukt, kinotoxin, till kinin skulle inte ha fungerat om Woodward och Doering försökt utföra experimentet. En ledare från 2001 publicerad i Chemical & Engineering News ställde sig på Stork sida, men kontroversen lades så småningom ner en gång för alla när Williams och medarbetare framgångsrikt upprepade Woodwards föreslagna omvandling av kinotoxin till kinin 2007.
Kemisk struktur
Den aromatiska komponenten i kininmolekylen är en kinolin med en metoxisubstituent . Aminkomponenten har ett kinuklidinskelett och metylenbryggan mellan de två komponenterna har en hydroxylgrupp . Substituenten i 3-positionen är en vinylgrupp . Molekylen är optiskt aktiv med fem stereogena centra (N1 och C4 utgör en enda asymmetrisk enhet), vilket gör syntesen potentiellt svår eftersom den är en av 16 stereoisomerer .
Kinin total syntes tidslinje
- 1817 : Första isoleringen av kinin från cinchonaträd av Pierre Joseph Pelletier och Joseph Caventou.
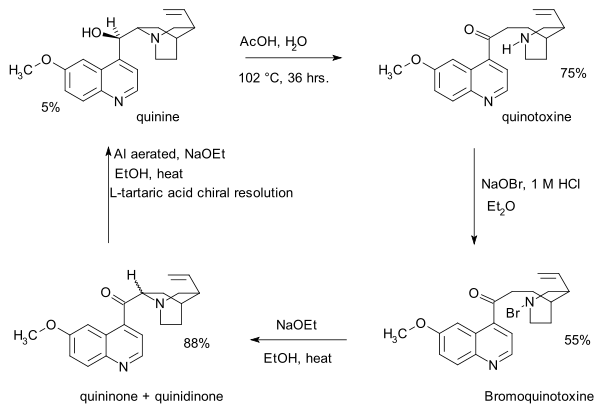
- 1853 : Louis Pasteur erhåller kinotoxin (eller kinicin i äldre litteratur) genom syrakatalyserad isomerisering av kinin.
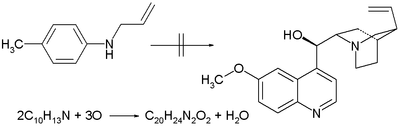
- 1856 : Sir William Henry Perkin försöker kininsyntes genom oxidation av N - allyltoluidin baserat på den felaktiga idén att två ekvivalenter av denna förening med kemisk formel C 10 H 13 N plus tre ekvivalenter syre ger en ekvivalent av C 20 H 24 N 2 O 2 (kinins kemiska formel) och en ekvivalent vatten. Hans oxidationer med andra toluidiner sätter honom på vägen för att upptäcka mauveine . Den kommersiella betydelsen av mauveine ledde så småningom till födelsen av den kemiska industrin.
- 1907 : den korrekta atomanslutningen etablerad av Paul Rabe.
- 1918 : Paul Rabe och Karl Kindler syntetiserar kinin från kinotoxin, vilket vänder på Pasteur-kemin. Bristen på experimentella detaljer i denna publikation skulle bli en viktig fråga i Stork–Woodward-kontroversen nästan ett sekel senare.

- Det första steget i denna sekvens är tillsats av natriumhypobromit till kinotoxin till en N -bromo-mellanprodukt eventuellt med struktur 2. Det andra steget är organisk oxidation med natriumetoxid i etanol . På grund av de grundläggande förhållandena omvandlas den initiala produkten kininon med kinidinon via en vanlig enol- mellanprodukt och mutarotation observeras. I det tredje steget reduceras ketongruppen med aluminiumpulver och natriumetoxid i etanol och kinin kan identifieras. Kinotoxin är den första relämolekylen i Woodward/Doering-påståendet.

- 1939 : Rabe och Kindler undersöker om ett prov som blivit över från deras experiment från 1918 och identifierar och isolerar kinin (igen) tillsammans med diastereomererna kinidin , epi-kinin och epi-kinidin .
- 1940 : Robert Burns Woodward skriver på som konsult för Polaroid Corporation på begäran av Edwin H. Land . Kinin är av intresse för Polaroid för dess ljuspolariserande egenskaper.
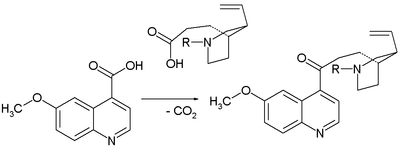
- 1943 : Prelog och Proštenik omvandlar en allylpiperidin som kallas homomerokinen och kinotoxin. Homomerokinen (den andra relämolekylen i Woodward/Doering-kravet) erhålls i flera steg från biomolekylen cinchonine ( relaterad till kinidin men utan metoxigruppen ):
- Nyckelsteget i sammansättningen av kinotoxin är en Claisen-kondensation :
- 1944 : Robert Burns Woodward och WE Doering rapporterar syntesen av kinin, utgående från 7- hydroxiisokinolin . Även om titeln på deras ensidiga publikation är Den totala syntesen av kinin är det konstigt nog inte syntesen av kinin utan den av prekursorn homomerokinen (racemisk) och sedan med grundarbete som redan tillhandahållits av Prelog ett år tidigare för kinotoxin (enantioprent efter kiral upplösning ) som beskrivs.

- Woodward och Doering hävdar att Rabe redan 1918 bevisade att denna förening så småningom kommer att ge kinin men upprepar inte Rabes arbete. I detta projekt är den 27-årige biträdande professorn Woodward teoretikern och postdoc Doering (26 år) bänkarbetaren. Enligt William kunde Bob koka vatten men ett ägg skulle vara en utmaning. Eftersom många naturliga kininresurser var uppbundna i de fientliga nederländska Ostindien , var syntetisk kinin ett lovande alternativ för att bekämpa malaria på slagfältet och båda männen blir omedelbara krigshjältar som skapar rubriker i New York Times , Newsweek och Life .
- 1944 : Den då 22-årige Gilbert Stork skriver till Woodward och frågar honom om han upprepade Rabes arbete.
- 1945 : Woodward och Doering publicerar sin andra långa kinintidning. En av de två referenterna förkastar manuskriptet (för mycket historiskt material, för mycket experimentella detaljer och dålig litterär stil med införande av ord som adumbrated och appposite ) men det publiceras utan ändringar ändå.
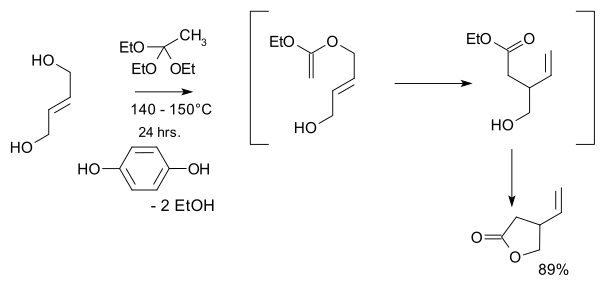
- 1974 : Kondo och Mori syntetiserar racemisk vinylisk gammalakton , ett viktigt utgångsmaterial i Storks 2001 kininsyntes.
- Utgångsmaterialen är trans-2-buten-1,4-diol och etylortoacetat och nyckelsteget är en Claisen-omlagring
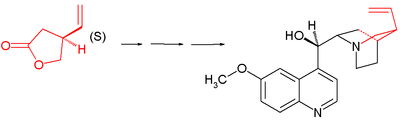
- 1988 : Ishibashi & Taniguchy löser upp nämnda lakton till enantiorena föreningar via kiral upplösning :

- I denna process reagerar den racemiska laktonen i aminolys. med ( S ) -metylbensylamin assisterad av trietylaluminium till ett diastereomert par av amider som kan separeras genom kolonnkromatografi . S - enantiomeren omvandlas tillbaka till S -laktonen i två steg genom hydrolys med kaliumhydroxid och etylenglykol följt av azeotropisk ringslutning.
- 2001 : Gilbert Stork publicerar sin stereoselektiva kininsyntes. Han ifrågasätter giltigheten av Woodward/Doering-påståendet: "grunden för deras karakterisering av Rabes påstående som "etablerad" är oklar". M. Jacobs, som skriver i The Chemical & Engineering News , är lika kritisk.
- 2007 : Forskaren Jeffrey I. Seeman drar i en 30-sidig recension slutsatsen att Woodward–Doering–Rabe–Kindlers totala syntes av kinin är en giltig prestation. Han noterar att Paul Rabe var en extremt erfaren alkaloidkemist , att han hade stora möjligheter att jämföra sin kininreaktionsprodukt med autentiska prover och att den beskrivna kemin från 1918 upprepades av Rabe även om inte med kinotoxin i sig men fortfarande med närbesläktade derivat.
- 2008 : Smith och Williams återbesöker och bekräftar Rabes d -kinotoxin till kinin-väg.
- 2018 : Nuno Maulide och hans team rapporterar den totala syntesen av kinin via CH-aktivering , inklusive analoger med förbättrad antimalariaaktivitet
Stork kinin total syntes
Stork-kininsyntesen utgår från kiral ( S )-4-vinylbutyrolakton 1 . Föreningen erhålls genom kiral upplösning och faktiskt, i de efterföljande stegen, sätts alla stereogena centra på plats genom kiral induktion : sekvensen innehåller inte asymmetriska steg.

|
|
|
| Storkkininsyntes | Vi introducerar C8 och kväve |
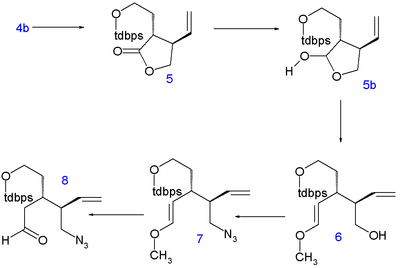
Laktonen ringöppnas med dietylamin till amid 2 och dess hydroxylgrupp skyddas som en tert - butyldimetylsilyleter ( TBS ) i 3 . C5- och C6-atomerna tillsätts som tert -butyldifenylsilyl (TBDPS) skyddad jodetanol i en nukleofil substitution av sur C4 med litiumdiisopropylamid (LDA) vid -78 °C till 4 med korrekt stereokemi. Avlägsnande av silylskyddsgruppen med p -toluensulfonsyra till alkohol 4b och ringslutning genom azeotropisk destillation återför föreningen till lakton 5 (direkt alkylering av 1 mötte oupptäckta problem).
Laktonen reduceras sedan till laktol 5b med diisobutylaluminiumhydrid och dess frigjorda aldehyd reagerar i en Wittig-reaktion med metoximetylentrifenylfosfin (som levererar C8-atomen) för att bilda enoleter 6 . Hydroxylgruppen ersätts i en Mitsunobu-reaktion med en azidgrupp med difenylfosforylazid i 7 och syrahydrolys ger azido-aldehyden 8 .

|

|
|
| Första ringförslutning | Andra ringförslutning |
Metylgruppen i 6-metoxi-4-metylkinolin 9 är tillräckligt sur för nukleofil addition av dess anjon (genom reaktion med LDA ) till aldehydgruppen i 8 för att bilda 10 som en blandning av epimerer . Detta har ingen betydelse för stereokontrollen eftersom alkoholen i nästa steg oxideras i en Swern-oxidation till keton 11 . En Staudinger-reaktion med trifenylfosfin stänger ringen mellan ketonen och aziden till tetrahydropyridinen 12 . Imingruppen i denna förening reduceras till aminen 13 med natriumborhydrid med korrekt stereospecificitet . Silylskyddsgruppen avlägsnas med vätefluorid till alkohol 14 och aktiveras sedan som en lämnande mesylgrupp genom reaktion med mesylklorid i pyridin vilket möjliggör den tredje ringen till 15 . I det sista steget infördes C9-hydroxylgruppen genom oxidation med natriumhydrid , dimetylsulfoxid och syre med ett förhållande av kinin till epikinin på 14:1.
Woodward-Doering formell kinin total syntes
Woodward-Doering-syntesen från 1944 utgår från 7-hydroxiisokinolin 3 för kinuklidinskelettet , vilket är något kontraintuitivt eftersom man går från ett stabilt heterocykliskt aromatiskt system till en fullständigt mättad bicyklisk ring. Denna förening (redan känd sedan 1895) framställs i två steg.

|
|
|
| Woodward/Doering kininsyntes del I | Del II |
Det första reaktionssteget är kondensationsreaktion av 3-hydroxibensaldehyd 1 med (formellt) diacetalen av aminoacetaldehyd till iminen 2 och det andra reaktionssteget är cyklisering i koncentrerad svavelsyra . Isokinolin 3 alkyleras sedan i en annan kondensation med formaldehyd och piperidin och produkten isoleras som natriumsaltet av 4 .

|
|
| Woodward/Doering kininsyntes del III |
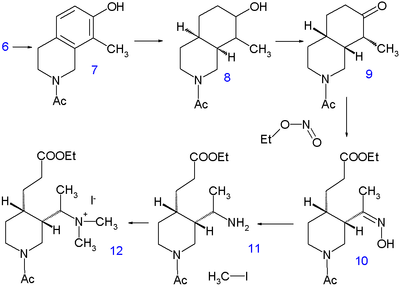
Hydrogenering vid 220 °C i 10 timmar i metanol med natriummetoxid frigör piperidingruppen och lämnar metylgruppen i 5 med redan alla kol- och kväveatomer redovisade. En andra hydrering sker med Adams katalysator i ättiksyra till tetrahydroisokinolin 6 . Ytterligare hydrering sker inte förrän aminogruppen acyleras med ättiksyraanhydrid i metanol , men då hydreras 7 igen med Raney-nickel i etanol vid 150 °C under högt tryck till dekahydroisokinolin 8 . Blandningen av cis- och transisomerer oxideras . sedan med kromsyra i ättiksyra till ketonen 9 Endast cis-isomeren kristalliserar och används i nästa reaktionssteg, en ringöppning med alkylnitriten etylnitrit med natriumetoxid i etanol till 10 med en nybildad karboxylsyraestergrupp och en oximgrupp . Oximgruppen hydreras till aminen 11 med platina i ättiksyra och alkylering med jodmetan ger det kvartära ammoniumsaltet 12 och därefter betainet 13 efter reaktion med silveroxid .
Kinins vinylgrupp konstrueras sedan genom Hofmann-eliminering med natriumhydroxid i vatten vid 140 °C. Denna process åtföljs av hydrolys av både ester- och amidgruppen men det är inte den fria aminen som isoleras utan urean 14 genom reaktion med kaliumcyanat . I nästa steg förestras karboxylsyragruppen med etanol och ureagruppen ersätts med en bensoylgrupp . Det sista steget är en claisen-kondensation av 15 med etylkininat 16 , som efter sur upparbetning ger racemiskt kinotoxin 17 . Den önskade enantiomeren erhålls genom kiral upplösning med den kirala dibensoylestern av vinsyra . Omvandlingen av denna förening till kinin är baserad på Rabe-Kindler-kemin som diskuterades i tidsperioden.
externa länkar
- Quinine Total Syntheses @ SynArchive.com
- Kininberättelse på Harvard.edu Link