Kanamycin kinas
| kanamycinkinas | |||||||||
|---|---|---|---|---|---|---|---|---|---|
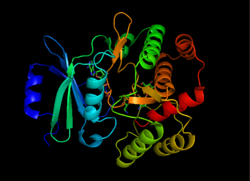 Struktur för APH(3'), hämtad från 1L8T-
| |||||||||
| identifierare | |||||||||
| EG nr. | 2.7.1.95 | ||||||||
| CAS-nr. | 62213-36-9 | ||||||||
| Databaser | |||||||||
| IntEnz | IntEnz-vy | ||||||||
| BRENDA | BRENDA inträde | ||||||||
| ExPASy | NiceZyme-vy | ||||||||
| KEGG | KEGG inträde | ||||||||
| MetaCyc | Metabolisk väg | ||||||||
| PRIAM | profil | ||||||||
| PDB- strukturer | RCSB PDB PDBe PDB summa | ||||||||
| Genontologi | AmiGO / QuickGO | ||||||||
| |||||||||
Aminoglykosid-3'-fosfotransferas (APH(3')), även känt som aminoglykosidkinas , är ett enzym som primärt katalyserar tillsatsen av fosfat från ATP till 3'-hydroxylgruppen i en 4,6-disubstituerad aminoglykosid , som t.ex. kanamycin . Men APH(3') har också visat sig fosforylera vid 5'-hydroxylgruppen i 4,5-disubstituerade aminoglykosider, som saknar en 3'-hydroxylgrupp, och difosforylera hydroxylgrupper i aminoglykosider som har både 3'- och 5'-hydroxylgrupper. Aminoglykosider, huvudsakligen positivt laddade vid biologiska förhållanden, binder till den negativt laddade ryggraden i nukleinsyror för att störa proteinsyntesen , vilket effektivt hämmar bakteriell celltillväxt. APH(3')-medierad fosforylering av aminoglykosider stör effektivt deras verkningsmekanism och introducerar en fosfatgrupp som minskar deras bindningsaffinitet på grund av steriska hinder och ogynnsamma elektrostatiska interaktioner. APH(3') finns främst i vissa arter av grampositiva bakterier .
Detta enzym tillhör familjen transferaser , särskilt de som överför fosforinnehållande grupper ( fosfotransferaser ) med en alkoholgrupp som acceptor. Det systematiska namnet på denna enzymklass är ATP:kanamycin 3'-O-fosfotransferas . Detta enzym kallas också neomycin-kanamycin fosfotransferas .
Strukturera
APH(3') gynnar termodynamiskt en dimer form av två identiska APH(3')-monomerer som är förbundna med två disulfidbindningar mellan Cys19 och Cys156, med de aktiva platserna vända mot varandra. Det stora avståndet mellan de två monomerernas aktiva ställen tyder emellertid på att de är oberoende av varandra och inte fungerar på ett kooperativt sätt. Dessutom påverkar dimerisering av APH(3') inte enzymets aktivitet.
Varje monomer består av två lober, den beta- arkrika N-terminalen och den alfa-helixrika C -terminalen , med en region med tolv aminosyror som förbinder de två. Den N-terminala loben är sammansatt av 5 antiparallella ß-ark, med en α-helix mellan blad 3 och 4. Den C-terminala loben är uppdelad i en central kärnregion (två α-helixar och en hårnålsslinga följt av fyra ß-sheets), en insertregion (två α-helixar förbundna med en slingstruktur) och en C-terminal region (två α-helixar). Den resulterande fickan som är inkapslad av de två loberna utgör enzymets aktiva plats. Denna ficka består till stor del av negativt laddade aminosyrarester, som stabiliserar den positiva laddningen av och orienterar substratet i det aktiva stället. Dessutom tros denna ficka bidra till enzymets promiskuitet, vilket gör att det kan ta in och stabilisera flera olika typer av aminoglykosider.
Mekanism
Medan tidigare studier av APH(3') stödde en mekanism som involverade den nukleofila attacken av γ-fosfat av 3'-hydroxylen, tyder nyare studier på att APH(3') katalyserar överföringen av γ-fosfatet från ATP till en aminoglykosid genom en dissociativ mekanism , där deprotonering av substratet inte är kritisk för fosfatöverföring, utan istället stabiliseringen av ett metafosfatövergångstillstånd . Dessutom har APH(3') en nukleotidpositioneringsslinga (NPL) som sluter sig på enzymets aktiva plats efter bindning av ATP, vilket underlättar fosforyleringen av 3'-hydroxylgruppen. Nyckeln till korrekt positionering av fosfatgruppen är Ser27- och Met26-rester. Inledningsvis underlättar två magnesiumjoner stabiliserade av Asn195 och Asp208 bindningen av ATP i det aktiva stället och orienterar ß- och y-fosfatgrupperna. NPL genomgår sedan en konformationsförändring för att bilda en vätebindning mellan Ser27 och ß-fosfatgruppen. Vid bindning av substrat genomgår APH(3') ytterligare en konformationsförändring för att orientera Ser27 så att dess amidryggrad stör anpassningen av ß-fosfat och y-fosfat, vilket försvagar y-fosfatbindningen. Amidryggraden i Met26 bildar en vätebindning med metafosfatet för att stabilisera övergångstillståndet, eftersom en magnesiumjon (betecknad Mg1) sedan förlänger y-fosfatbindningen, bryter den och effektivt fosforylerar hydroxylgruppen.
Evolution och biologisk funktion
Den centrala kärnregionen av APH(3') har en hög grad av konformationell likhet med regioner av serin/tyrosin och treoninproteinkinaser, funktionellt ekvivalenta enzymer som finns i eukaryoter. Dessutom röntgenkristallografi och mutagenes av nyckelaktiva platser påståenden om att APH(3') och eukaryota proteinkinaser är relaterade, trots att de delar mindre än 10 % av det totala restinnehållet. Flera studier har föreslagit att serin/tyrosin/treonin-proteinkinaser, som en gång troddes endast förekomma i eukaryoter, också finns i prokaryoterna. Dessutom har det visat sig att aminoglykosidbiosyntes kräver fosforylering av hydroxylgrupper under vissa steg av syntesen. Det har alltså spekulerats i att APH(3') och andra proteinkinaser härstammar från enzymer från den metaboliska vägen för aminoglykosider och utvecklats för att motverka de toxiska effekterna av dessa antibiotika i värdbakteriecellen.
Användning i forskning
Aminoglykosidresistensgener används ofta inom gentekniken för att selektera efter korrekt transformerade bakteriella organismer. Vid konstruktion av en vektorplasmid är inklusive antibiotikaresistens i vektorn avgörande för att effektivt uttrycka genen av intresse. Antibiotika, såsom aminoglykosiderna kanamycin eller neomycin , tillsätts till kulturerna under tillväxtfaserna för att selektivt förstöra de celler som inte effektivt tog upp plasmiden.
Vidare läsning
- Doi O, Ogura M, Tanaka N, Umezawa H (sep 1968). "Inaktivering av kanamycin, neomycin och streptomycin av enzymer erhållna i celler av Pseudomonas aeruginoa" . Tillämpad mikrobiologi . 16 (9): 1276–81. doi : 10.1128/AEM.16.9.1276-1281.1968 . PMC 547640 . PMID 4970990 .
- Dolin MI (mars 1957). "Streptococcus faecalis-oxidaserna för reducerad difosfopyridin-nukleotid. III. Isolering och egenskaper hos ett flavinperoxidas för reducerad difosfopyridin-nukleotid" . Journal of Biological Chemistry . 225 (1): 557–73. doi : 10.1016/S0021-9258(18)64952-X . PMID 13416259 .



