Bly(II)klorid

|
|

|
|
| Namn | |
|---|---|
|
IUPAC-namn
Bly(II)klorid Blydiklorid |
|
| Andra namn Plumbous klorid Cotunnite |
|
| Identifierare | |
|
3D-modell ( JSmol )
|
|
| ChEBI | |
| ChemSpider | |
| ECHA InfoCard | 100.028.950 |
| EG-nummer |
|
|
PubChem CID
|
|
| UNII | |
|
CompTox Dashboard ( EPA )
|
|
|
|
|
|
| Egenskaper | |
| PbCl2 _ | |
| Molar massa | 278,10 g/mol |
| Utseende | vitt luktfritt fast ämne |
| Densitet | 5,85 g/cm 3 |
| Smältpunkt | 501 °C (934 °F; 774 K) |
| Kokpunkt | 950 °C (1 740 °F; 1 220 K) |
| 0,99 g/100 ml (20 °C) | |
|
Löslighetsprodukt ( K sp )
|
1,7×10 −5 (20 °C) |
| Löslighet |
lätt löslig i utspädd HCl , ammoniak ; olösligt i alkohol Löslig i varmt vatten samt i närvaro av alkalihydroxid Löslig i aktuell HCl (>6M) |
| −73,8·10 −6 cm 3 /mol | |
|
Brytningsindex ( n D )
|
2,199 |
| Strukturera | |
| Ortorhombic , oP12 | |
| Pnma, nr 62 | |
| Termokemi | |
|
Std molär entropi ( S ⦵ 298 ) |
135,98 JK -1 mol -1 |
|
Std formationsentalpi ( Δ f H ⦵ 298 ) |
-359,41 kJ/mol |
| Faror | |
| GHS- märkning : | |
  
|
|
| Fara | |
| H302 , H332 , H351 , H360 , H372 , H410 | |
| P201 , P261 , P273 , P304+P340 , P308+P313 , P312 , P391 | |
| NFPA 704 (branddiamant) | |
| Dödlig dos eller koncentration (LD, LC): | |
|
LD Lo ( lägst publicerad )
|
140 mg/kg (marsvin, oralt) |
| Besläktade föreningar | |
|
Andra anjoner
|
Bly(II)fluorid Bly(II)bromid Bly(II)jodid |
|
Andra katjoner
|
Bly(IV)klorid Tenn(II)klorid Germanium(II)klorid |
|
Besläktade föreningar
|
Tallium(I)klorid Vismutklorid |
| Kompletterande datasida | |
| Bly(II)klorid (datasida) | |
|
Om inte annat anges ges data för material i standardtillstånd (vid 25 °C [77 °F], 100 kPa).
|
|
Bly(II)klorid (PbCl2 ) är en oorganisk förening som är en vit fast substans under omgivande förhållanden. Det är dåligt lösligt i vatten. klorid är ett av de viktigaste blybaserade reagenserna . Den förekommer också naturligt i form av mineralet cotunnit .
Struktur och egenskaper
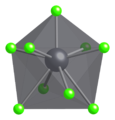
I fast PbCl 2 koordineras varje blyjon av nio kloridjoner i en trekantig triangulär prismaformation - sex ligger vid hörnen på ett triangulärt prisma och tre ligger utanför mitten av varje rektangulär prismayta. De 9 kloridjonerna är inte lika långt från den centrala blyatomen, 7 ligger vid 280–309 pm och 2 vid 370 pm. PbCl 2 bildar vita ortorombiska nålar.
Ball-and-stick modell av en del av kristallstrukturen av cotunnite
Koordinationsgeometri för Pb 2+
I gasfasen har PbCl 2 -molekyler en böjd struktur med Cl–Pb–Cl-vinkeln på 98° och varje Pb–-Cl-bindningsavstånd är 2,44 Å. Sådan PbCl 2 släpps ut från förbränningsmotorer som använder etylenklorid- tetraetylblytillsatser för knackningsskydd.
PbCl 2 är svårlösligt i vatten, löslighetsprodukt K sp = 1,7 × 10 −5 vid 20 °C. Det är en av endast 5 vanligtvis vattenolösliga klorider, de andra 4 är tallium(I)klorid , silverklorid (AgCl) med K sp = 1,8 × 10 −10 , koppar(I)klorid (CuCl) med K sp = 1,72 × 10 −7 och kvicksilver(I)klorid (Hg 2 Cl 2 ) med K sp = 1,3 × 10 −18 .
Syntes
Fast bly(II)klorid fälls ut vid tillsats av vattenhaltiga kloridkällor (HCl, NaCl, KCl) till vattenlösningar av bly (II)föreningar, såsom bly(II)nitrat och bly(II)acetat :
- Pb(NO3 ) 2 + HCl → PbCl2 ( s) + 2 HNO3
Det bildas också genom behandling av basiska bly(II)-föreningar som ** bly(II)oxid och bly(II)karbonat .
Blydioxid reduceras med klorid enligt följande:
- PbO2 + 4 HCl → PbCl2 ( s) + Cl2 + 2 H2O
Det bildas också genom oxidation av blymetall med koppar(II)klorid :
- Pb + CuCl2 → PbCl2 + Cu
Eller enklast genom verkan av klorgas på blymetall:
- Pb + Cl2 → PbCl2
Reaktioner
Tillsats av kloridjoner till en suspension av PbCl2 ger upphov till lösliga komplexa joner. I dessa reaktioner bryter den ytterligare kloriden (eller andra ligander ) upp kloridbryggorna som utgör det polymera ramverket av fast PbCl2( s) .
- PbCl 2(s) + Cl − → [PbCl 3 ] − (aq)
- PbCl 2(s) + 2 Cl − → [PbCl 4 ] 2− (aq)
PbCl 2 reagerar med smält NaNO 2 för att ge PbO :
- PbCl 2(l) + 3 NaNO2 → PbO + NaNO3 + 2 NO + 2 NaCl
PbCl 2 används vid syntes av bly(IV) klorid (PbCl 4 ): Cl 2 bubblas genom en mättad lösning av PbCl 2 i vattenhaltig NH 4 Cl och bildar [NH 4 ] 2 [PbCl 6 ]. Den senare reageras med kall koncentrerad svavelsyra (H2SO4 ) och bildar PbCl4 som en olja .
Bly(II)klorid är den huvudsakliga prekursorn för organometalliska derivat av bly, såsom plumbocener . De vanliga alkyleringsmedlen används, inklusive Grignard-reagenser och organolitiumföreningar:
- 2 PbCl2 + 4 RLi → R 4 Pb + 4 LiCl + Pb
- 2 PbCl 2 + 4 RMgBr → R 4 Pb + Pb + 4 MgBrCl
- 3 PbCl 2 + 6 RMgBr → R 3 Pb-PbR 3 + PbCl + 6 MgBr
Dessa reaktioner ger derivat som liknar kiselorganiska föreningar, dvs att Pb(II) tenderar att bli oproportionerlig vid alkylering.
PbCl 2 kan användas för att producera PbO 2 genom att behandla det med natriumhypoklorit (NaClO), vilket bildar en rödbrun fällning av PbO 2 .
Används
- Smält PbCl 2 används vid syntes av blytitanat- och bariumblytitanatkeramer genom katjonersättningsreaktioner:
- x PbCl 2(l) + BaTiO 3(s) → Ba 1− x Pb x TiO 3 + x BaCl 2
- PbCl 2 används vid framställning av infrarött sändande glas och prydnadsglas som kallas aurenglas. Aurene-glas har en iriserande yta bildad genom sprayning med PbCl 2 och återuppvärmning under kontrollerade förhållanden. Tenn( II )klorid (SnCl2 ) används för samma ändamål.
- Pb används i HCl-tjänst även om den bildade PbCl2 är svagt löslig i HCl. Tillsats av 6–25 % antimon (Sb) ökar korrosionsbeständigheten.
- En basisk klorid av bly, PbCl 2 ·Pb(OH) 2 , är känd som Pattinsons vita bly och används som pigment i vit färg. Blyfärg är nu förbjudet som en hälsorisk i många länder enligt White Lead (Painting) Convention, 1921 .
- PbCl 2 är en mellanprodukt vid raffinering av vismut (Bi) malm. Malmen som innehåller Bi, Pb och Zn behandlas först med smält kaustiksoda för att avlägsna spår av arsenik och tellur . Detta följs av Parkes-processen för att ta bort eventuellt silver och guld som finns. Det finns nu Bi, Pb och Zn i malmen. Vid 500 °C behandlas den från Cl2-gas. Först bildas ZnCl2 och utsöndras. Pure Bi lämnas kvar efter att PbCl2 bildats och elimineras. Slutligen skulle BiCl3 bildas.
Giftighet
Liksom andra lösliga blyföreningar kan exponering för PbCl 2 orsaka blyförgiftning .