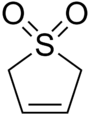
Sulfolen
|
|
|||
| Namn | |||
|---|---|---|---|
|
IUPAC-namn
2,5-dihydrotiofen 1,1-dioxid
|
|||
|
Föredraget IUPAC-namn
2,5-dihydro-1H - 1A6 - tiofen-1,1-dion |
|||
| Andra namn Butadiensulfon 3-Sulfolen |
|||
| Identifierare | |||
|
3D-modell ( JSmol )
|
|||
| ChemSpider | |||
| ECHA InfoCard | 100.000.964 | ||
|
PubChem CID
|
|||
| UNII | |||
|
CompTox Dashboard ( EPA )
|
|||
|
|||
| Egenskaper | |||
| C4H6O2S _ _ _ _ _ _ | |||
| Molar massa | 118,15 g·mol -1 | ||
| Smältpunkt | 65 till 66 °C (149 till 151 °F; 338 till 339 K) | ||
|
Om inte annat anges ges data för material i standardtillstånd (vid 25 °C [77 °F], 100 kPa).
|
|||
Sulfolene eller butadiensulfon är en cyklisk organisk kemikalie med en funktionell sulfongrupp . Det är ett vitt, luktfritt, kristallint fast ämne som kan lagras på obestämd tid, som löser sig i vatten och många organiska lösningsmedel. Föreningen används som butadienkälla .
Produktion
Sulfolen bildas av den keletropiska reaktionen mellan butadien och svaveldioxid. Reaktionen utförs typiskt i en autoklav. Små mängder hydrokinon eller pyrogallol tillsätts för att hämma polymerisationen av dien. Reaktionen fortskrider vid rumstemperatur under loppet av dagar. Vid 130 °C krävs endast 30 minuter. Ett analogt förfarande ger den isopren- härledda sulfonen.
Reaktioner
Syra-bas-reaktivitet
Föreningen är opåverkad av syror. Det kan till och med omkristalliseras från konc. HNO 3 .
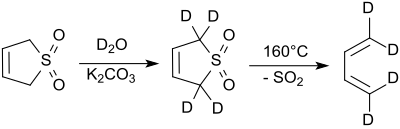
Protonerna i 2- och 5-positionerna utbyts snabbt med deuteriumoxid under alkaliska förhållanden. Natriumcyanid katalyserar denna reaktion.
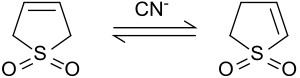
Isomerisering till 2-sulfolen
I närvaro av bas eller cyanid isomeriserar 3-sulfolen till en blandning av 2-sulfolen och 3-sulfolen.
Vid 50°C erhålls en jämviktsblandning innehållande 42 % 3-sulfolen och 58 % 2-sulfolen. Den termodynamiskt mer stabila 2-sulfolenen kan isoleras från blandningen av isomerer som ren substans i form av vita plattor (smp 48-49 °C) genom uppvärmning i flera dagar vid 100 °C, på grund av den termiska nedbrytningen av de 3 -sulfolen vid temperaturer över 80 °C.
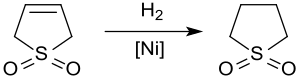
Hydrering
Katalytisk hydrering ger sulfolan , ett lösningsmedel som används i den petrokemiska industrin för extraktion av aromater från kolväteströmmar . Hydrogeneringen av 3-sulfolen över Raney-nickel vid ca. 20 bar och 60 °C ger sulfolan i utbyte på upp till 65 % endast på grund av förgiftningen av katalysatorn av svavelföreningar.
Halogenering
3-Sulfolen reagerar i vattenlösning med brom för att ge 3,4-dibromtetrohydrotiofen-1,1-dioxid, som kan dehydrobromeras till tiofen-1,1-dioxid med silverkarbonat . Tiofen-1,1-dioxid, ett mycket reaktivt ämne, är också tillgängligt via bildning av 3,4-bis(dimetylamino)tetrahydrotiofen-1,1-dioxid och successiv dubbel kvaternisering med metyljodid och Hofmann -eliminering med silverhydroxid .
En mindre besvärlig tvåstegssyntes är den tvåfaldiga dehydrobromeringen av 3,4-dibromotetrohydrotiofen-1,1-dioxid med antingen pulveriserad natriumhydroxid i tetrahydrofuran (THF) eller med ultraljudsdispergerat metalliskt kalium .
Diels-Alder reaktioner
3-sulfolen är främst värderad som en stand-in för butadien. In situ -produktionen och den omedelbara konsumtionen av 1,3-butadien undviker i stort sett kontakt med dien, som är en gas vid rumstemperatur. En potentiell nackdel, förutom kostnaden, är att den utvecklade svaveldioxiden kan orsaka sidoreaktioner med syrakänsliga substrat.
Diels-Alder-reaktionen mellan 1,3-butadien och dienofiler med låg reaktivitet kräver vanligtvis långvarig uppvärmning över 100 °C. Sådana procedurer är ganska farliga. Om ren butadien används krävs specialutrustning för arbete under högt tryck. Med sulfolen kunde ingen ansamling av butadientryck förväntas eftersom den frigjorda dien förbrukas i cykloadditionen, och därför fungerar jämvikten i den reversibla extruderingsreaktionen som en inre "säkerhetsventil".
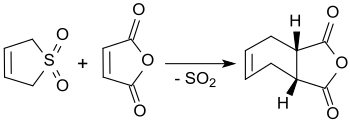
3-Sulfolen reagerar med maleinsyraanhydrid i kokande xylen till cis-4-cyklohexen-1,2-dikarboxylsyraanhydrid, vilket ger utbyten på upp till 90 %.
3-Sulfolen reagerar också med dienofiler i trans -konfiguration (såsom dietylfumarat) vid 110 °C med SO 2- eliminering i 66–73 % utbyte till trans-4-cyklohexen-1,2-dikarboxyldietylestern.
6,7-dibrom-1,4-epoxi-1,4-dihydronaftalen (6,7-dibromonaftalen-1,4-endoxid, tillgänglig efter debromering från 1,2,4,5-tetrabrombensen med användning av en ekvivalent av n-butyllitium och Diels-Alder-reaktion i furan i 70 % utbyte) reagerar med 3-sulfolen i kokande xylen för att ge en tricyklisk addukt. Denna prekursor ger, efter behandling med perklorsyra, en dibromdihydroantracen som dehydreras i det sista steget med 2,3-diklor-5,6-dicyano-1,4-bensokinon (DDQ) till 2,3-dibromantracen.
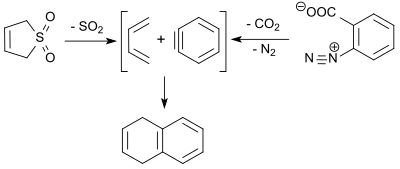
1,3-butadien (bildad i den retrokeletrofiska reaktionen av 3-sulfolen) reagerar med dehydrobensen ( bensen , erhållen genom termisk sönderdelning av bensendiazonium-2-karboxylat) i en Diels-Alder-reaktion i 9 % utbyte för att ge 1,4 -dihydronaftalen.
2- och 3-Sulfolener som en dienofil
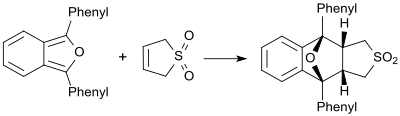
I närvaro av mycket reaktiva diener (till exempel 1,3-difenylisobensofuran) uppträder butadiensulfon som en dienofil och bildar motsvarande Diels-Alder-addukt.
Redan 1938 rapporterade Kurt Alder och medarbetare om Diels-Alder-addukter från den isomera 2-sulfolen med 1,3-butadien och 2-sulfolen med cyklopentadien .
Andra cykloadditioner
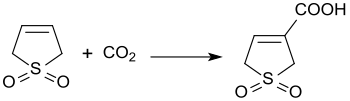
Den baskatalyserade reaktionen av 3-sulfolen med koldioxid vid 3 bars tryck ger 3-sulfolen-3-karboxylsyra med 45 % utbyte.
Med diazometan bildas 3-sulfolen i en 1,3-dipolär cykloaddukt:
Polymerisation
1935 fann H. Staudinger och medarbetare att reaktionen av butadien och SO 2 vid rumstemperatur ger en andra produkt förutom 3-sulfolen. Denna andra produkt är en amorf fast polymer. Genom friradikalpolymerisation av 3-sulfolen i peroxidinnehållande dietyleter erhölls upp till 50 % olöslig polysulfolen med hög molekylvikt. Polymeren motstår nedbrytning av svavelsyra och salpetersyra.
I efterföljande undersökningar initierades polymerisation av 3-sulfolen över 100 °C med radikalinitiatorn azobis(isobutyronitril) (AIBN). 3-sulfolen sampolymeriserar dock inte med vinylföreningar . Å andra sidan homopolymeriserar inte 2-sulfolen utan bildar sampolymerer med vinylföreningar, t.ex. akrylnitril och vinylacetat .
3-Sulfolene som ett återvinningsbart lösningsmedel
Reversibiliteten av omvandlingen av 3-sulfolen med buta-1,3-dien och svaveldioxid tyder på användningen av sulfolen som ett återvinningsbart aprotiskt dipolärt lösningsmedel, i ersättning för dimetylsulfoxid (DMSO), som ofta används men är svår att separera och dåligt återanvändbart. Som en modellreaktion undersöktes reaktionen av bensylazid med 4-toluensulfonsyracyanid som bildar 1-bensyl-5-(4-toluensulfonyl)tetrazol. Bildningen av tetrazolen kan också utföras som en enkärlsreaktion utan isolering av bensylaziden med 72 % totalt utbyte.
Efter reaktionen sönderdelas lösningsmedlet 3-sulfolen vid 135 °C och den flyktiga butadienen (kokpunkt -4,4 °C) och svaveldioxid (kokpunkt -10,1 °C) avsätts i en kylfälla vid -76 °C laddad med överskott svaveldioxid. Efter tillsats av hydrokinon som polymerisationsinhibering bildas 3-sulfoler igen kvantitativt vid upphettning till rumstemperatur. Det förefaller dock tveksamt om 3-sulfolen med ett användbart vätskefasintervall på endast 64 till maximalt cirka 100 °C kan användas som DMSO-ersättningar (enkel hantering, låg kostnad, miljökompatibilitet) i industriell praxis.
Används
Förutom dess syntetiska mångsidighet (se ovan) används sulfolen som tillsats vid elektrokemisk fluorering . Det kan öka utbytet av perfluoroktansulfonylfluorid med cirka 70 %. Det är "mycket lösligt i vattenfri HF och ökar ledningsförmågan hos elektrolytlösningen". I denna applikation genomgår den en ringöppning och fluoreras för att bilda perfluorbutansulfonylfluorid .
Vidare läsning
- DE 506839 , H. Staudinger, "Verfahren zur Darstellung von monomolekularen Reaktionsprodukten von ungesättigten Kohlenwasserstoffen der Butadienreihe mit Schwefeldioxyd", publicerad 1930-08-28, tilldelad H. Staudinger