Myosin-lätt kedja fosfatas
| Myosin Light-Chain Phosphatase | |||||||||
|---|---|---|---|---|---|---|---|---|---|
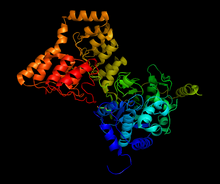 Struktur av komplex mellan PP1 och en del av MYPT1, genererad från 1s70
| |||||||||
| Identifiers | |||||||||
| EG nr. | 3.1.3.53 | ||||||||
| CAS-nr. | 86417-96-1 | ||||||||
| Databaser | |||||||||
| IntEnz | IntEnz-vy | ||||||||
| BRENDA | BRENDA inträde | ||||||||
| ExPASy | NiceZyme-vy | ||||||||
| KEGG | KEGG inträde | ||||||||
| MetaCyc | Metabolisk väg | ||||||||
| PRIAM | profil | ||||||||
| PDB- strukturer | RCSB PDB PDBe PDB summa | ||||||||
| Genontologi | AmiGO / QuickGO | ||||||||
| |||||||||
Myosin-lättkedjefosfatas , även kallat myosinfosfatas (EC 3.1.3.53; systematiskt namn [myosin-lättkedja]-fosfatfosfohydrolas ), är ett enzym (specifikt ett serin/treonin-specifikt proteinfosfatas ) som defosforylerar lätta kedjan av myosin II :
- [myosin lätt kedja] fosfat + H 2 O = [myosin lätt kedja] + fosfat
Denna defosforyleringsreaktion inträffar i glatt muskelvävnad och initierar avslappningsprocessen i muskelcellerna. Således ångrar myosinfosfatas muskelkontraktionsprocessen som initieras av myosin lättkedjekinas . Enzymet är sammansatt av tre subenheter: den katalytiska regionen ( proteinfosfatas 1 eller PP1), den myosinbindande subenheten (MYPT1) och en tredje subenhet (M20) med okänd funktion. Den katalytiska regionen använder två manganjoner som katalysatorer för att defosforylera lätta kedjor på myosin, vilket orsakar en konformationsförändring i myosinet och slappnar av muskeln. Enzymet är mycket konserverat och finns i alla organismers glatta muskelvävnad. Även om det är känt att myosinfosfatas regleras av rho-associerade proteinkinaser , finns det aktuell debatt om huruvida andra molekyler, såsom arakidonsyra och cAMP , också reglerar enzymet.
Fungera
Slät muskelvävnad är mestadels gjord av aktin och myosin, två proteiner som interagerar tillsammans för att producera muskelkontraktion och avslappning. Myosin II, även känt som konventionellt myosin, har två tunga kedjor som består av huvud- och svansdomänerna och fyra lätta kedjor (två per huvud) som binder till de tunga kedjorna i "hals"-regionen. När muskeln behöver dra ihop sig kalciumjoner in i cytosolen från det sarkoplasmatiska retikulumet , där de aktiverar kalmodulin, vilket i sin tur aktiverar myosin lättkedjekinas (MLC kinas). MLC-kinas fosforylerar myosinets lätta kedja (MLC20 ) vid Ser-19-resten. Denna fosforylering orsakar en konformationsförändring i myosinet, aktiverar crossbridge-cykling och får muskeln att dra ihop sig. Eftersom myosin genomgår en konformationsförändring kommer muskeln att förbli sammandragen även om kalcium- och aktiverat MLC-kinaskoncentrationer bringas till normala nivåer. Konformationsförändringen måste ångras för att slappna av i muskeln.
När myosinfosfatas binder till myosin tar det bort fosfatgruppen . Utan gruppen återgår myosinet till sin ursprungliga konformation, där det inte kan interagera med aktinet och hålla muskeln spänd, så muskeln slappnar av. Muskeln kommer att förbli i denna avslappnade position tills myosinet fosforyleras av MLC-kinas och genomgår en konformationsförändring.
Strukturera
Myosinfosfatas består av tre underenheter. Den katalytiska subenheten, PP1, är en av de viktigare Ser/Thr-fosfataserna i eukaryota celler , eftersom den spelar en roll i glykogenmetabolism , intracellulär transport, proteinsyntes och celldelning samt sammandragning av glatta muskler. Eftersom det är så viktigt för grundläggande cellulära funktioner, och eftersom det finns mycket färre proteinfosfataser än kinaser i celler, är PP1:s struktur och funktion mycket konserverad (även om den specifika isoformen som används i myosinfosfatas är δ-isoformen, PP1δ). PP1 fungerar genom att använda två manganjoner som katalysatorer för defosforyleringen (se nedan).
Runt dessa joner finns en Y-formad klyfta med tre spår: ett hydrofobt, ett surt och ett C-terminalt spår. När PP1 inte är bunden till någon annan subenhet är den inte speciellt specifik. Men när den binder till den andra subenheten av myosinfosfatas, MYPT1 (MW ~130 kDa), ändrar denna katalytiska klyfta konfiguration. Detta resulterar i en dramatisk ökning av myosinspecificiteten. Således är det tydligt att MYPT1 har stor reglerande makt över PP1 och myosinfosfatas, även utan närvaro av andra aktivatorer eller hämmare.
Den tredje subenheten, M20 (inte att förväxla med MLC 20 , den kritiska regulatoriska subenheten av myosin), är den minsta och mest mystiska subenheten. För närvarande är lite känt om M20, förutom att det inte är nödvändigt för katalys, eftersom att ta bort subenheten inte påverkar omsättning eller selektivitet. Även om vissa tror att det kan ha en reglerande funktion, har ingenting bestämts ännu.
Mekanism
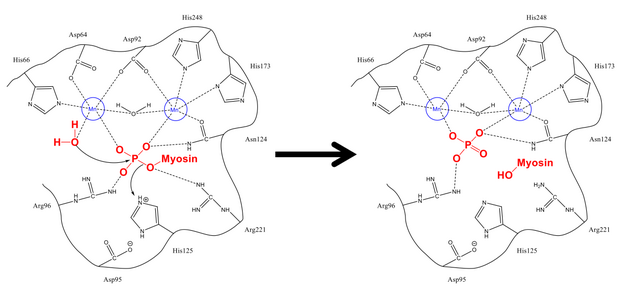
Mekanismen för att ta bort fosfatet från Ser-19 är mycket lik andra defosforyleringsreaktioner i cellen, såsom aktiveringen av glykogensyntas . Myosins regulatoriska subenhet MLC 20 binder till både de hydrofoba och sura spåren i PP1 och MYPT1, det regulatoriska stället på myosinfosfatas. Väl i rätt konfiguration stabiliseras både det fyosforylerade serinet och en fri vattenmolekyl av de vätebindande resterna i det aktiva stället, såväl som de positivt laddade jonerna (som interagerar starkt med den negativa fosfatgruppen). His-125 (på myosinfosfatas) donerar en proton till Ser-19 MLC 20 ), och vattenmolekylen angriper fosforatomen . Efter att ha blandat protoner för att stabilisera sig (vilket sker snabbt jämfört med attacken på fosfor), bildas fosfatet och alkoholen, och båda lämnar den aktiva platsen.
Reglering och människors hälsa
De regulatoriska vägarna för MLC-kinas har varit väletablerade, men fram till slutet av 1980-talet antogs det att myosinfosfatas inte var reglerat, och kontraktion/avslappning var helt beroende av MLC-kinasaktivitet. Men sedan 1980-talet har den hämmande effekten av rho-associerat proteinkinas upptäckts och grundligt undersökts. RhoA GTP aktiverar Rho-kinas , som fosforylerar MYPT1 vid två huvudsakliga hämmande ställen, Thr-696 och Thr-866. Detta visar till fullo värdet av MYPT1, inte bara för att öka reaktionshastigheten och specificiteten, utan också för att kraftigt bromsa reaktionen. Men när telokin tillsätts upphäver det effektivt effekten av Rho-kinas, även om det inte defosforylerar MYPT1.
En annan föreslagen regleringsstrategi involverar arakidonsyra. När arakidonsyra tillsätts till spänd muskelvävnad, minskar syran hastigheten för defosforylering (och därmed avslappning) av myosin. Det är dock oklart hur arakidonsyra fungerar som en hämmare . Två konkurrerande teorier är att antingen fungerar arakidonsyra som en co-budbärare i rho-kinas-kaskaden som nämns ovan, eller att den binder till c-terminalen av MYPT1.
När regleringssystemen för myosinfosfatas börjar brista kan det få stora hälsokonsekvenser. Eftersom glatt muskulatur finns i människors andnings-, cirkulations- och reproduktionssystem (liksom på andra ställen), om den glatta muskulaturen inte längre kan slappna av på grund av felaktig reglering, kommer ett stort antal problem, allt från astma , högt blodtryck och erektil dysfunktion kan resultera.
Se även
Vidare läsning
- Pato MD, Adelstein RS (1983). "Rening och karakterisering av en multisubunit fosfatas från kalkon magmuskel. Effekten av calmodulin bindning till myosin lätt kedja kinas på defosforylering" . J. Biol. Chem . 258 (11): 7047–54. doi : 10.1016/S0021-9258(18)32330-5 . PMID 6304072 .
- Kimura K; et al. (1996). "Reglering av myosinfosfatas av Rho och Rho-associerat kinas (Rho-kinase)". Vetenskap . 273 (5272): 245–248. Bibcode : 1996Sci...273..245K . doi : 10.1126/science.273.5272.245 . PMID 8662509 . S2CID 37249779 .