Moderlig effekt
En maternell effekt är en situation där fenotypen av en organism bestäms inte bara av miljön den upplever och dess genotyp , utan också av miljön och genotypen av dess mor. Inom genetik uppstår mödraeffekter när en organism visar den fenotyp som förväntas av moderns genotyp, oberoende av dess egen genotyp, ofta på grund av att modern levererar budbärar-RNA eller proteiner till ägget. Maternal effekter kan också orsakas av moderns miljö oberoende av genotyp, ibland styr avkommans storlek, kön eller beteende . Dessa adaptiva modereffekter leder till fenotyper av avkommor som ökar deras kondition. Vidare introducerar det begreppet fenotypisk plasticitet , ett viktigt evolutionärt koncept. Det har föreslagits att moderns effekter är viktiga för utvecklingen av adaptiva svar på miljöheterogenitet.
Inom genetik
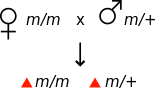
Inom genetik uppstår en maternell effekt när fenotypen av en organism bestäms av genotypen av dess mor. Till exempel, om en mutation är recessiv från modern, kan en hona som är homozygot för mutationen verka fenotypiskt normal, men hennes avkomma kommer att visa den muterade fenotypen, även om de är heterozygota för mutationen.
| Moderlig effekt | |||
|---|---|---|---|
| Alla avkommor visar vildtypsfenotypen | Alla avkommor visar den muterade fenotypen | ||
Maternal effekter uppstår ofta eftersom mamman tillför ett visst mRNA eller protein till oocyten, därför avgör moderns genom om molekylen är funktionell. Maternal tillförsel av mRNA till det tidiga embryot är viktigt, eftersom embryot i många organismer initialt är transkriptionellt inaktivt. På grund av arvsmönstret av mutationer med maternal effekt krävs speciella genetiska undersökningar för att identifiera dem. Dessa involverar vanligtvis att undersöka fenotypen av organismerna en generation senare än i en konventionell ( zygotisk ) screening, eftersom deras mödrar kommer att vara potentiellt homozygota för mutationer med maternal effekt som uppstår.
I Drosophila tidig embryogenes
En Drosophila melanogaster -oocyt utvecklas i en äggkammare i nära anslutning till en uppsättning celler som kallas sjuksköterskeceller . Både oocyten och sjuksköterskecellerna härstammar från en enda könslinjestamcell, men cytokinesen är ofullständig i dessa celldelningar , och cytoplasman hos sjuksköterskecellerna och oocyten är förbundna med strukturer som kallas ringkanaler. Endast oocyten genomgår meios och bidrar med DNA till nästa generation.
Många Drosophila- mutanter med maternal effekt har hittats som påverkar de tidiga stegen i embryogenes såsom axelbestämning, inklusive bicoid , dorsal, gurken och oskar . Till exempel misslyckas embryon från homozygota bicoida mödrar att producera huvud- och bröstkorgstrukturer .
När genen som är störd i den bicoida mutanten identifierats, visades det att bicoid mRNA transkriberas i sjuksköterskecellerna och sedan omlokaliseras till oocyten. Andra mutanter med maternal effekt påverkar antingen produkter som på liknande sätt produceras i sjuksköterskecellerna och verkar i oocyten, eller delar av transportmaskineriet som krävs för denna omlokalisering. Eftersom dessa gener uttrycks i (moderns) sjuksköterskeceller och inte i oocyten eller det befruktade embryot, avgör moderns genotyp om de kan fungera.
Gener för maternal effekt uttrycks under oogenes av modern (uttryckt före befruktning) och utvecklar äggets främre-posteriora och dorsala ventrala polaritet. Äggets främre ände blir huvudet; bakre änden blir svansen. ryggsidan är på toppen; den ventrala sidan är intill. Produkterna av gener med maternal effekt som kallas maternal mRNA produceras av sjuksköterskeceller och follikelceller och deponeras i äggcellerna (oocyterna). I början av utvecklingsprocessen bildas mRNA-gradienter i oocyter längs anterior-posterior och dorsala ventrala axlar.
Ett trettiotal moderns gener är involverade i mönsterbildning har identifierats. Speciellt är produkter av fyra gener med maternal effekt kritiska för bildandet av främre-bakre axel. Produkten av två gen med maternal effekt, bicoid och puckelrygg, reglerar bildandet av främre struktur medan ett annat par nanos och caudal, specificerar protein som reglerar bildandet av den bakre delen av embryot.
Transkriptet av alla fyra generna - bicoid, puckelrygg, caudal, nanos syntetiseras av sjuksköterska och follikelceller och transporteras in i oocyterna.
Hos fåglar
Hos fåglar kan mödrar överföra hormoner i sina ägg som påverkar en avkommas tillväxt och beteende. Experiment på inhemska kanariefåglar har visat att ägg som innehåller mer äggula androgener utvecklas till kycklingar som uppvisar mer social dominans. Liknande variation i äggula androgennivåer har setts i fågelarter som den amerikanska sothönan , även om effektmekanismen ännu inte har fastställts.
I människor
År 2015 publicerade fetmateoretikern Edward Archer "The Childhood Obesity Epidemic as a Result of Nogenetic Evolution: The Maternal Resources Hypothesis" och en serie arbeten om moderns effekter på mänsklig fetma och hälsa. I detta arbete hävdade Archer att ackumulerande effekt på modern via den icke-genetiska utvecklingen av matrilineal näringsämnesmetabolism är ansvarig för den ökade globala prevalensen av fetma och diabetes mellitus typ 2 . Archer menade att minskningar i moderns metaboliska kontroll förändrade fostrets bukspottkörtelbeta- cell , adipocyt (fettcell) och myocyt (muskelcell) utveckling och därigenom inducerade en bestående konkurrensfördel för adipocyter i förvärvet och sekvestreringen av näringsenergi.
I växter
De miljösignaler som ljus, temperatur, markfuktighet och näringsämnen som moderplantan möter kan orsaka variationer i frökvalitet, även inom samma genotyp. Således påverkar moderväxten i hög grad fröegenskaper som fröstorlek, groningshastighet och livsduglighet.
Miljömässiga mödraeffekter
Moderns miljö eller tillstånd kan också i vissa situationer påverka fenotypen av hennes avkomma, oberoende av avkommans genotyp.
Faderlig effektgener
Däremot är en faderlig effekt när en fenotyp är resultatet av faderns genotyp snarare än individens genotyp. Generna som är ansvariga för dessa effekter är komponenter av spermier som är involverade i befruktning och tidig utveckling. Ett exempel på en gen med faderlig effekt är ms(3)sneaky i Drosophila . Hanar med en mutant allel av denna gen producerar spermier som kan befrukta ett ägg, men de smyg-inseminerade äggen utvecklas inte normalt. Men honor med denna mutation producerar ägg som genomgår normal utveckling när de befruktas.
Adaptiva modereffekter
Adaptiva modereffekter inducerar fenotypiska förändringar hos avkomman som resulterar i en ökad kondition. Dessa förändringar uppstår genom att mödrar känner av miljösignaler som arbetar för att minska avkommans kondition och sedan reagerar på dem på ett sätt som sedan "förbereder" avkomman för deras framtida miljöer. En viktig egenskap hos fenotyper med "adaptiv maternal effekter" är deras plasticitet. Fenotypisk plasticitet ger organismer förmågan att reagera på olika miljöer genom att ändra deras fenotyp. Med dessa "förändrade" fenotyper som ökar konditionen blir det viktigt att titta på sannolikheten för att adaptiva modereffekter kommer att utvecklas och bli en betydande fenotypisk anpassning till en miljö.
Definiera adaptiva modereffekter
När egenskaper påverkas av antingen moderns miljö eller moderns fenotyp, sägs det påverkas av moderns effekter. Maternal effekter verkar för att förändra fenotyperna hos avkomman genom andra vägar än DNA. Adaptiva modereffekter är när dessa moderspåverkan leder till en fenotypisk förändring som ökar avkommans kondition. Generellt sett är adaptiva modereffekter en mekanism för att klara av faktorer som verkar för att minska avkommans kondition; de är också miljöspecifika.
Det kan ibland vara svårt att skilja mellan moderns och adaptiva modereffekter. Tänk på följande: Zigenarmalar uppfödda på löv av svart ek, snarare än kastanjeek, fick avkommor som utvecklades snabbare. Detta är en moderlig, inte en adaptiv modereffekt. För att vara en adaptiv modereffekt måste moderns miljö ha lett till en förändring av avkommans matvanor eller beteende. Den viktigaste skillnaden mellan de två är därför att adaptiva modereffekter är miljöspecifika. De fenotyper som uppstår är som svar på att mamman känner av en miljö som skulle minska konditionen hos hennes avkomma. Genom att ta hänsyn till denna miljö kan hon sedan ändra fenotyperna för att faktiskt öka avkommans kondition. Maternal effekter är inte ett svar på en miljösignal, och vidare har de potential att öka avkommans kondition, men de kanske inte.
När man tittar på sannolikheten för att dessa "förändrade" fenotyper utvecklas finns det många faktorer och signaler inblandade. Adaptiva modereffekter utvecklas endast när avkomma kan möta många potentiella miljöer; när en mamma kan "förutsäga" miljön i vilken hennes avkomma kommer att födas; och när en mamma kan påverka sin avkommas fenotyp och därigenom öka deras kondition. Summeringen av alla dessa faktorer kan sedan leda till att dessa "förändrade" egenskaper blir gynnsamma för evolutionen.
De fenotypiska förändringarna som uppstår från adaptiva modereffekter är ett resultat av att mamman känner att en viss aspekt av miljön kan minska överlevnaden för hennes avkomma. När mamman känner av en signal "förmedlar" informationen till den utvecklande avkomman och inducerar därför adaptiva modereffekter. Detta tenderar att sedan leda till att avkomman får en högre kondition eftersom de är "förberedda" för den miljö de sannolikt kommer att uppleva. Dessa ledtrådar kan inkludera svar på rovdjur, livsmiljöer, hög befolkningstäthet och mattillgång
Ökningen i storlek på nordamerikanska röda ekorrar är ett bra exempel på en adaptiv effekt på modern som producerar en fenotyp som resulterade i en ökad kondition. Den adaptiva mödraeffekten inducerades av att mödrarna kände av den höga befolkningstätheten och korrelerade den med låg mattillgång per individ. Hennes avkomma var i genomsnitt större än andra ekorrar av samma art; de växte också snabbare. I slutändan visade ekorrarna som föddes under denna period med hög befolkningstäthet en ökad överlevnadsgrad (och därmed kondition) under sin första vinter.
Fenotypisk plasticitet
När vi analyserar de typer av förändringar som kan inträffa i en fenotyp kan vi se förändringar som är beteendemässiga, morfologiska eller fysiologiska. Ett kännetecken för fenotypen som uppstår genom adaptiva modereffekter är denna fenotyps plasticitet. Fenotypisk plasticitet gör det möjligt för organismer att anpassa sin fenotyp till olika miljöer, och därigenom förbättra deras lämplighet för förändrade miljöförhållanden. I slutändan är det ett nyckelattribut för en organisms och en populations förmåga att anpassa sig till kortsiktiga miljöförändringar.
Fenotypisk plasticitet kan ses i många organismer, en art som exemplifierar detta koncept är fröbaggen Stator limbatus . Denna fröbagge reproducerar sig på olika värdväxter, två av de vanligaste är Cercidium floridum och Acacia greggii . När C. floridum är värdväxt, finns det urval för en stor äggstorlek; när A. greggii är värdväxt finns det ett urval för en mindre äggstorlek. I ett experiment såg man att när en skalbagge som vanligtvis lade ägg på A. greggii sattes på C. floridum , var överlevnaden för de värpta äggen lägre jämfört med de ägg som producerades av en skalbagge som konditionerades och stannade kvar på C. florium värdväxt. I slutändan visade dessa experiment plasticiteten i äggstorleksproduktionen hos skalbaggen, såväl som påverkan av moderns miljö på avkommans överlevnad.
Ytterligare exempel på adaptiva modereffekter
Hos många insekter:
- Ledtrådar som snabbt svalkande temperaturer eller minskande dagsljus kan resultera i avkommor som går in i ett vilande tillstånd. De kommer därför bättre att överleva kylningstemperaturerna och bevara energi.
- När föräldrar tvingas lägga ägg i miljöer med låga näringsämnen kommer avkomman att förses med mer resurser, såsom högre näringsämnen, genom en ökad äggstorlek.
- Ledtrådar som dålig livsmiljö eller trängsel kan leda till avkomma med vingar. Vingarna tillåter avkomman att flytta bort från fattiga miljöer till sådana som kommer att ge bättre resurser.
Moderns kost och miljö påverkar epigenetiska effekter
Relaterade till adaptiva modereffekter är epigenetiska effekter. Epigenetik är studiet av långvariga förändringar i genuttryck som produceras av modifieringar av kromatin istället för förändringar i DNA-sekvens, som man kan se vid DNA-mutation. Denna "förändring" hänvisar till DNA-metylering , histonacetylering eller interaktionen av icke-kodande RNA med DNA. DNA-metylering är tillägget av metylgrupper till DNA:t. När DNA metyleras i däggdjur stängs transkriptionen av genen på den platsen ner eller stängs av helt. Induktionen av DNA-metylering påverkas starkt av moderns miljö. Vissa moderns miljöer kan leda till en högre metylering av en avkommas DNA, medan andra lägre metylering.[22] [ citat behövs ] Det faktum att metylering kan påverkas av moderns miljö, gör det liknar adaptiva moderns effekter. Ytterligare likheter ses av att metylering ofta kan öka konditionen hos avkomman. Dessutom kan epigenetik hänvisa till histonmodifieringar eller icke-kodande RNA som skapar ett slags cellulärt minne . Cellulärt minne hänvisar till en cells förmåga att överföra icke-genetisk information till sin dottercell under replikering. Till exempel, efter differentiering, utför en levercell andra funktioner än en hjärncell; cellulärt minne tillåter dessa celler att "komma ihåg" vilka funktioner de ska utföra efter replikering. Vissa av dessa epigenetiska förändringar kan överföras till framtida generationer, medan andra är reversibla under en viss individs livstid. Detta kan förklara varför individer med identiskt DNA kan skilja sig åt i sin mottaglighet för vissa kroniska sjukdomar.
För närvarande undersöker forskare sambanden mellan moderns kost under graviditeten och dess effekt på avkommans mottaglighet för kroniska sjukdomar senare i livet. Fostrets programmeringshypotes lyfter fram tanken att miljöstimuli under kritiska perioder av fostrets utveckling kan ha livslånga effekter på kroppsstruktur och hälsa och på sätt och vis förbereder de avkomman för miljön de kommer att födas in i. Många av dessa variationer tros bero på epigenetiska mekanismer som orsakas av moderns miljö som stress, kost, graviditetsdiabetes och exponering för tobak och alkohol. Dessa faktorer tros vara bidragande faktorer till fetma och hjärt- och kärlsjukdomar, neuralrörsdefekter, cancer, diabetes, etc. Studier för att fastställa dessa epigenetiska mekanismer utförs vanligtvis genom laboratoriestudier av gnagare och epidemiologiska studier av människor.
Betydelse för den allmänna befolkningen
Kunskap om moderns kostinducerade epigenetiska förändringar är viktig inte bara för forskare utan för allmänheten. Den kanske mest uppenbara platsen av betydelse för moderns kosteffekter är inom det medicinska området. I USA och över hela världen har många icke-smittsamma sjukdomar, såsom cancer, fetma och hjärtsjukdomar, nått epidemiska proportioner. Det medicinska området arbetar med metoder för att upptäcka dessa sjukdomar, av vilka några har upptäckts vara starkt drivna av epigenetiska förändringar på grund av moderns kosteffekter. När de genomiska markörerna för dessa sjukdomar har identifierats, kan forskning börja implementeras för att identifiera den tidiga uppkomsten av dessa sjukdomar och eventuellt vända de epigenetiska effekterna av moderns kost i senare livsstadier. Omvändningen av epigenetiska effekter kommer att använda det farmaceutiska området i ett försök att skapa läkemedel som riktar sig mot specifika gener och genomiska förändringar. Skapandet av läkemedel för att bota dessa icke-smittsamma sjukdomar skulle kunna användas för att behandla individer som redan har dessa sjukdomar. Allmän kunskap om mekanismerna bakom moderns dietära epigenetiska effekter är också fördelaktigt när det gäller medvetenhet. Allmänheten kan vara medveten om riskerna med vissa dietbeteenden under graviditeten i ett försök att stävja de negativa konsekvenser som kan uppstå hos avkomman senare i livet. Epigenetisk kunskap kan leda till en allmänt hälsosammare livsstil för miljarder människor världen över.
Effekten av moderns kost hos andra arter än människor är också relevant. Många av de långsiktiga effekterna av globala klimatförändringar är okända. Kunskap om epigenetiska mekanismer kan hjälpa forskare att bättre förutsäga effekterna av förändrade samhällsstrukturer på arter som är ekologiskt, ekonomiskt och/eller kulturellt viktiga runt om i världen. Eftersom många ekosystem kommer att se förändringar i artstrukturer, kommer tillgången på näringsämnen också att förändras, vilket i slutändan påverkar de tillgängliga matvalen för reproducerande honor. Maternal kosteffekter kan också användas för att förbättra jordbruks- och vattenbruksmetoder. Uppfödare kanske kan använda vetenskapliga data för att skapa mer hållbara metoder och spara pengar för sig själva och konsumenterna.
Moderns kost och miljö påverkar epigenetiskt känsligheten för vuxensjukdomar
Hyperglykemi under graviditet tros orsaka epigenetiska förändringar i leptiingenen hos nyfödda, vilket leder till en potentiell ökad risk för fetma och hjärtsjukdomar. Leptin är ibland känt som "mättnadshormonet" eftersom det frisätts av fettceller för att hämma hunger. Genom att studera både djurmodeller och mänskliga observationsstudier har det föreslagits att en leptinökning i perinatalperioden spelar en avgörande roll för att bidra till långsiktig risk för fetma. Perinatalperioden börjar vid 22 veckors graviditet och slutar en vecka efter födseln.[34] DNA-metylering nära leptinlokuset har undersökts för att fastställa om det fanns en korrelation mellan maternell glykemi och neonatala leptinnivåer. Resultaten visade att glykemi var omvänt associerad med metyleringstillstånden av LEP-genen, som kontrollerar produktionen av leptinhormonet. Därför motsvarade högre glykemiska nivåer hos mödrar lägre metyleringstillstånd i LEP-genen hos deras barn. Med detta lägre metyleringstillstånd transkriberas LEP-genen oftare, vilket inducerar högre blodleptinnivåer. Dessa högre blodleptinnivåer under perinatalperioden var kopplade till fetma i vuxen ålder, kanske på grund av att en högre "normal" nivå av leptin sattes under graviditeten. Eftersom fetma är en stor bidragande orsak till hjärtsjukdomar, är denna leptinökning inte bara korrelerad med fetma utan även hjärtsjukdom.
Fettrik kost i livmodern tros orsaka metabolt syndrom. Metaboliskt syndrom är en uppsättning symtom inklusive fetma och insulinresistens som verkar vara relaterade. Detta syndrom är ofta förknippat med typ II-diabetes samt högt blodtryck och åderförkalkning. Med hjälp av mössmodeller har forskare visat att dieter med hög fetthalt i livmodern orsakar modifieringar av adiponektin- och leptinegenerna som förändrar genuttrycket; dessa förändringar bidrar till metabolt syndrom. Adiponektingenerna reglerar glukosmetabolismen såväl som fettsyranedbrytningen; dock är de exakta mekanismerna inte helt klarlagda. I både mänskliga och mössmodeller har adiponectin visat sig tillföra insulinsensibiliserande och antiinflammatoriska egenskaper till olika typer av vävnader, speciellt muskel- och levervävnad. Adiponectin har också visat sig öka hastigheten för fettsyratransport och oxidation hos möss, vilket orsakar en ökning av fettsyrametabolismen. Med en diet med hög fetthalt under graviditeten skedde en ökning av metylering i promotorn av adiponektingenen åtföljd av en minskning av acetylering. Dessa förändringar hämmar sannolikt transkriptionen av adiponektingenerna eftersom ökningar i metylering och minskningar av acetylering vanligtvis undertrycker transkription. Dessutom skedde en ökning av metylering av leptinpromotorn, vilket minskar produktionen av leptingenen. Därför fanns det mindre adiponektin för att hjälpa celler att ta upp glukos och bryta ner fett, samt mindre leptin för att ge en mättnadskänsla. Minskningen av dessa hormoner orsakade ökning av fettmassan, glukosintolerans, hypertriglyceridemi, onormala adiponektin- och leptinnivåer och högt blodtryck under djurets livstid. Effekten avskaffades dock efter tre efterföljande generationer med normal kost. Denna studie belyser det faktum att dessa epigenetiska märken kan förändras i så många som en generation och kan till och med elimineras helt över tiden. Denna studie visade på sambandet mellan dieter med hög fetthalt och adiponektin och leptin hos möss. Däremot har få studier gjorts på människor för att visa de specifika effekterna av fettrik kost i livmodern på människor. Det har dock visat sig att minskade adiponektinnivåer är associerade med fetma, insulinresistens, typ II-diabetes och kranskärlssjukdom hos människor. Det postuleras att en liknande mekanism som den som beskrivs hos möss också kan bidra till metabolt syndrom hos människor.
Dessutom orsakar dieter med hög fetthalt kronisk låggradig inflammation i moderkakan, fettet, levern, hjärnan och kärlsystemet. Inflammation är en viktig aspekt av kroppens naturliga försvarssystem efter skada, trauma eller sjukdom. Under ett inflammatoriskt svar uppstår en serie fysiologiska reaktioner, såsom ökat blodflöde, ökad cellulär metabolism och vasodilatation, för att hjälpa till att behandla det skadade eller infekterade området. Kronisk låggradig inflammation har dock kopplats till långsiktiga konsekvenser såsom hjärt-kärlsjukdom, njursvikt, åldrande, diabetes, etc. Denna kroniska låggradiga inflammation ses ofta hos överviktiga individer på dieter med hög fetthalt. I en mössmodell upptäcktes överskott av cytokiner i möss som matades på en diet med hög fetthalt. Cytokiner hjälper till med cellsignalering under immunsvar, och skickar specifikt celler till platser för inflammation, infektion eller trauma. mRNA från proinflammatoriska cytokiner inducerades i moderkakan hos mödrar på dieter med hög fetthalt. Den fettrika dieten orsakade också förändringar i mikrobiotisk sammansättning, vilket ledde till hyperinflammatoriska kolonresponser hos avkomman. Detta hyperinflammatoriska svar kan leda till inflammatoriska tarmsjukdomar som Crohns sjukdom eller ulcerös kolit .[35] Som tidigare nämnts bidrar fettrik dieter in utero till fetma; Men vissa proinflammatoriska faktorer, som IL-6 och MCP-1, är också kopplade till kroppsfettavlagring. Det har föreslagits att histonacetylering är nära förknippat med inflammation eftersom tillsatsen av histondeacetylashämmare har visat sig minska uttrycket av proinflammatoriska mediatorer i gliaceller . Denna minskning av inflammation resulterade i förbättrad neurala cellfunktion och överlevnad. Denna inflammation är också ofta förknippad med fetma, hjärt-kärlsjukdomar, fettlever , hjärnskador samt havandeskapsförgiftning och för tidig födsel. Även om det har visat sig att dieter med hög fetthalt framkallar inflammation, vilket bidrar till alla dessa kroniska sjukdomar; det är oklart hur denna inflammation fungerar som en mediator mellan kost och kronisk sjukdom.
En studie gjord efter den holländska hungervintern 1944-1945 visade att undernäring under de tidiga stadierna av graviditeten är förknippade med hypometylering av den insulinliknande tillväxtfaktor II (IGF2) -genen även efter sex decennier. Dessa individer hade signifikant lägre metyleringsfrekvenser jämfört med deras syskon av samma kön som inte hade blivit gravida under svälten. En jämförelse gjordes med barn som föddes före svälten så att deras mödrar var näringsberövade under de senare stadierna av graviditeten; dessa barn hade normala metyleringsmönster. IGF2 står för insulinliknande tillväxtfaktor II; denna gen är en nyckelfaktor för mänsklig tillväxt och utveckling. IGF2-genen är också maternellt präglad vilket betyder att moderns gen tystas. Moderns gen är typiskt metylerad vid den differentiellt metylerade regionen (DMR); men när den är hypometylerad uttrycks genen bialleliskt. Således förlorade sannolikt individer med lägre metyleringstillstånd en del av präglingseffekten. Liknande resultat har visats i generna Nr3c1 och Ppara från avkommor till råttor som matats med en diet med isokalorisk proteinbrist innan graviditeten påbörjades. Detta antyder vidare att undernäringen var orsaken till de epigenetiska förändringarna. Överraskande nog fanns det ingen korrelation mellan metyleringstillstånd och födelsevikt. Detta visade att födelsevikt kanske inte är ett adekvat sätt att bestämma näringsstatus under graviditeten. Denna studie betonade att epigenetiska effekter varierar beroende på tidpunkten för exponering och att tidiga stadier av däggdjursutveckling är avgörande perioder för att etablera epigenetiska märken. De som exponerades tidigare under graviditeten hade minskad metylering medan de som exponerades i slutet av graviditeten hade relativt normala metyleringsnivåer. Avkommor och ättlingar till mödrar med hypometylering var mer benägna att utveckla hjärt-kärlsjukdom. Epigenetiska förändringar som inträffar under embryogenes och tidig fosterutveckling har större fysiologiska och metaboliska effekter eftersom de överförs över mer mitotiska divisioner. Med andra ord, de epigenetiska förändringarna som inträffar tidigare är mer benägna att kvarstå i fler celler.
I en annan studie upptäckte forskare att perinatal näringsrestriktion som resulterar i intrauterin tillväxtrestriktion (IUGR) bidrar till diabetes mellitus typ 2 (DM2). IUGR hänvisar till den dåliga tillväxten av barnet i livmodern. I bukspottkörteln orsakade IUGR en minskning av uttrycket av promotorn för genen som kodar för en kritisk transkriptionsfaktor för betacellsfunktion och utveckling. Bukspottkörtelns betaceller är ansvariga för att tillverka insulin; minskad betacellsaktivitet är associerad med DM2 i vuxen ålder. I skelettmuskulaturen orsakade IUGR en minskning av uttrycket av Glut-4-genen. Glut-4-genen styr produktionen av Glut-4-transportören; denna transportör är speciellt känslig för insulin. När insulinnivåerna stiger förs alltså fler glut-4-transportörer till cellmembranet för att öka upptaget av glukos i cellen. Denna förändring orsakas av histonmodifieringar i skelettmuskelcellerna som minskar effektiviteten hos glukostransportsystemet in i muskeln. Eftersom de viktigaste glukostransportörerna inte fungerar med optimal kapacitet, är dessa individer mer benägna att utveckla insulinresistens med energirik kost senare i livet, vilket bidrar till DM2.
Ytterligare studier har undersökt de epigenetiska förändringarna till följd av en diet med hög protein/lågkolhydrathalt under graviditeten. Denna diet orsakade epigenetiska förändringar som var förknippade med högre blodtryck, högre kortisolnivåer och en förhöjd reaktion på hypotalamus-hypofys-binjureaxeln (HPA) på stress. Ökad metylering i 11β-hydroxisteroiddehydrogenas typ 2 (HSD2), glukokortikoidreceptor (GR) och H19 ICR var positivt korrelerade med fett och blodtryck i vuxen ålder. Glukokortikoider spelar en viktig roll i vävnadsutveckling och mognad samt har effekter på ämnesomsättningen. Glukokortikoiders tillgång till GR regleras av HSD1 och HSD2. H19 är en präglad gen för ett långt kodande RNA (lncRNA), som har begränsande effekter på kroppsvikt och cellproliferation. Därför undertrycker högre metyleringshastigheter i H19 ICR transkription och förhindrar lncRNA från att reglera kroppsvikten. Mödrar som rapporterade högre intag av kött/fisk och grönsaker och lägre intag av bröd/potatis i slutet av graviditeten hade en högre genomsnittlig metylering i GR och HSD2. En vanlig utmaning för dessa typer av studier är dock att många epigenetiska modifieringar har vävnads- och celltypspecificitets-DNA-metyleringsmönster. Epigenetiska modifieringsmönster för tillgängliga vävnader, som perifert blod, kanske inte representerar de epigenetiska mönstren för den vävnad som är involverad i en viss sjukdom.
Starka bevis hos råttor stöder slutsatsen att neonatal östrogenexponering spelar en roll i utvecklingen av prostatacancer . Med hjälp av en human fosterprostata-xenograftmodell studerade forskarna effekterna av tidig exponering för östrogen med och utan sekundär östrogen- och testosteronbehandling. En xenograftmodell är ett transplantat av vävnad transplanterat mellan organismer av olika arter. I detta fall transplanterades mänsklig vävnad till råttor; därför fanns det inget behov av att extrapolera från gnagare till människor. Histopatologiska lesioner, proliferation och serumhormonnivåer mättes vid olika tidpunkter efter xenotransplantation. Vid dag 200 visade xenotransplantatet som hade exponerats för två behandlingar av östrogen de allvarligaste förändringarna. Dessutom tittade forskare på nyckelgener involverade i prostatakörtel- och stromaltillväxt, cellcykelprogression, apoptos, hormonreceptorer och tumörsuppressorer med hjälp av en anpassad PCR-array. Analys av DNA-metylering visade metyleringsskillnader i CpG-ställen i stromalavdelningen efter östrogenbehandling. Dessa variationer i metylering är sannolikt en bidragande orsak till förändringarna i de cellulära händelserna i KEGG prostatacancervägen som hämmar apoptos och ökar cellcykelprogression som bidrar till utvecklingen av cancer.
Tillskott kan vända epigenetiska förändringar
In utero eller neonatal exponering för bisfenol A (BPA), en kemikalie som används vid tillverkning av polykarbonatplast, är korrelerad med högre kroppsvikt, bröstcancer, prostatacancer och en förändrad reproduktionsfunktion. I en mössmodell var det mer sannolikt att mössen som matades på en BPA-diet hade en gul päls som motsvarar deras lägre metyleringstillstånd i promotorregionerna av retrotransposonen uppströms om Agoutigenen. Agoutigenen är ansvarig för att avgöra om ett djurs päls kommer att vara bandad (agouti) eller solid (icke-agouti). Men tillskott med metyldonatorer som folsyra eller fytoöstrogen avskaffade den hypometylerande effekten. Detta visar att de epigenetiska förändringarna kan vändas genom diet och kosttillskott.
Maternal kosteffekter och ekologi
Maternal kosteffekter ses inte bara hos människor, utan i många taxa i djurriket. Dessa effekter på moderns kost kan resultera i ekologiska förändringar i större skala i hela populationer och från generation till generation. Den plasticitet som är involverad i dessa epigenetiska förändringar på grund av moderns kost representerar miljön i vilken avkomman kommer att födas. Många gånger kommer epigenetiska effekter på avkomman från moderns kost under utveckling att genetiskt förbereda avkomman för att bli bättre anpassad för den miljö där de först kommer att möta. De epigenetiska effekterna av moderns kost kan ses hos många arter, genom att använda olika ekologiska ledtrådar och epigenetiska mekanismer för att ge en adaptiv fördel för framtida generationer.
Inom området ekologi finns det många exempel på moderns kosteffekter. Tyvärr undersöks de epigenetiska mekanismerna som ligger bakom dessa fenotypiska förändringar sällan. I framtiden skulle det vara fördelaktigt för ekologiska forskare såväl som epigenetiska och genomiska forskare att arbeta tillsammans för att fylla hålen inom ekologiområdet för att skapa en komplett bild av miljösignaler och epigenetiska förändringar som producerar fenotypisk mångfald.
Föräldrarnas kost påverkar avkommans immunitet
En art av pyralidfjärilar , Plodia interpunctella , som vanligtvis finns i matförvaringsområden, uppvisar maternala kosteffekter, såväl som faderliga dieteffekter, på sin avkomma. Epigenetiska förändringar i malavkommor påverkar produktionen av fenoloxidas, ett enzym involverat i melanisering och korrelerat med resistens hos vissa patogener hos många ryggradslösa arter. I denna studie inhystes föräldramalar i matrika eller matfattiga miljöer under sin reproduktionsperiod. Malar som hölls i matfattiga miljöer producerade avkomma med mindre fenoloxidas, och hade därmed ett svagare immunförsvar, än nattfjärilar som förökade sig i livsmedelsrika miljöer. Detta tros vara adaptivt eftersom avkomman utvecklas samtidigt som de får signaler om knappa näringsmöjligheter. Dessa signaler gör det möjligt för malen att fördela energi differentiellt, vilket minskar energin som allokeras till immunsystemet och ägnar mer energi åt tillväxt och reproduktion för att öka konditionen och försäkra framtida generationer. En förklaring till denna effekt kan vara prägling, uttrycket av endast en föräldragen över den andra, men ytterligare forskning har ännu inte gjorts.
Föräldramedierade dietära epigenetiska effekter på immunitet har en bredare betydelse på vilda organismer. Förändringar i immunitet genom en hel population kan göra befolkningen mer mottaglig för en miljöstörning, såsom introduktion av en patogen. Därför kan dessa transgenerationella epigenetiska effekter påverka populationsdynamiken genom att minska stabiliteten hos populationer som bor i miljöer som skiljer sig från den föräldramiljö som avkomman är epigenetiskt modifierad för.
Moderns kost påverkar avkommans tillväxthastighet
Tillgängligheten av föda påverkar också de epigenetiska mekanismerna som driver tillväxthastigheten hos den munbrännande cikliden Simochromis pleurospilus . När näringstillgången är hög kommer reproducerande honor att producera många små ägg, jämfört med färre, större ägg i näringsfattiga miljöer. Äggstorlek korrelerar ofta med fisklarvers kroppsstorlek vid kläckning: mindre larver kläcks från mindre ägg. När det gäller cikliden växer små larver i snabbare takt än sina större äggmotsvarigheter. Detta beror på det ökade uttrycket av GHR, tillväxthormonreceptorn. Ökade transkriptionsnivåer av GHR-gener ökar de receptorer som är tillgängliga för att binda med tillväxthormon, GH, vilket leder till en ökad tillväxthastighet hos mindre fiskar. Fiskar av större storlek är mindre benägna att ätas av rovdjur, därför är det fördelaktigt att växa snabbt i tidiga livsstadier för att säkerställa överlevnad. Mekanismen genom vilken GHR-transkription regleras är okänd, men det kan bero på hormoner i äggulan som produceras av mamman, eller bara av själva äggulakvantiteten. Detta kan leda till DNA-metylering eller histonmodifieringar som kontrollerar generiska transkriptionsnivåer.
Ekologiskt är detta ett exempel på att mamman använder sin miljö och bestämmer den bästa metoden för att maximera avkommans överlevnad, utan att faktiskt göra en medveten ansträngning för att göra det. Ekologi drivs i allmänhet av en organisms förmåga att tävla om att få näringsämnen och framgångsrikt föröka sig. Om en mamma kan samla en riklig mängd resurser kommer hon att få en högre fruktsamhet och få avkommor som kan växa snabbt för att undvika predation. Mödrar som inte kan få i sig så många näringsämnen kommer att producera färre avkommor, men avkomman kommer att bli större i hopp om att deras stora storlek kommer att hjälpa till att försäkra överlevnad till könsmognad. Till skillnad från malexemplet förbereder inte de maternala effekterna som ges till ciklidens avkomma cikliderne för miljön som de kommer att födas in i; detta beror på att ciklider som ruvar i mun ger föräldravård till sina avkommor, vilket ger en stabil miljö för avkomman att utvecklas. Avkommor som har en högre tillväxthastighet kan bli självständiga snabbare än långsamt växande motsvarigheter, vilket minskar mängden energi som föräldrarna spenderar under föräldravårdsperioden.
Ett liknande fenomen förekommer hos sjöborren , Strongylocentrotus droebachiensis . Urchin mödrar i näringsrika miljöer producerar ett stort antal små ägg. Avkommor från dessa små ägg växer i en snabbare takt än sina stora ägg motsvarigheter från näringsfattiga mödrar. Återigen är det fördelaktigt för sjöborrelarver, känd som planula , att växa snabbt för att minska varaktigheten av deras larvfas och omvandlas till en ungdom för att minska predationsriskerna. Sjöborrelarver har förmågan att utvecklas till en av två fenotyper, baserat på deras maternala och larvnäring. Larver som växer i snabb takt från hög näring, kan ägna mer av sin energi åt att utvecklas till den juvenila fenotypen. Larver som växer i en långsammare takt med låg näring, ägnar mer energi åt att växa ryggradsliknande bihang för att skydda sig mot rovdjur i ett försök att öka överlevnaden in i den unga fasen. Bestämningen av dessa fenotyper baseras på både moderns och den ungas näring. De epigenetiska mekanismerna bakom dessa fenotypiska förändringar är okända, men man tror att det kan finnas en näringströskel som utlöser epigenetiska förändringar som påverkar utvecklingen och i slutändan larvens fenotyp.