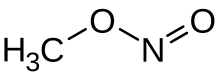
Metylnitrit
|
|

|
|
| Namn | |
|---|---|
|
Föredraget IUPAC-namn
Metylnitrit |
|
| Identifierare | |
|
3D-modell ( JSmol )
|
|
| ChemSpider | |
| ECHA InfoCard | 100.009.882 |
|
PubChem CID
|
|
| UNII | |
|
CompTox Dashboard ( EPA )
|
|
|
|
|
|
| Egenskaper | |
| CH 3 N O 2 _ | |
| Molar massa | 61,040 g·mol -1 |
| Utseende | Gul gas |
| Densitet | 0,991 g/cm 3 |
| Smältpunkt | −16 °C (3 °F; 257 K) |
| Kokpunkt | −12 °C (10 °F; 261 K) |
| Termokemi | |
|
Std formationsentalpi ( Δ f H ⦵ 298 ) |
-66,1 kJ/mol |
| Faror | |
| Säkerhetsdatablad (SDS) | Externt MSDS |
|
Om inte annat anges ges data för material i standardtillstånd (vid 25 °C [77 °F], 100 kPa).
|
|
Metylnitrit är en organisk förening med den kemiska formeln CH
3 ONO . Det är en gas och är den enklaste alkylnitriten .
Strukturera
rumstemperatur finns metylnitrit som en blandning av cis- och transkonformers . Cis - konformatorn är 3,13 kJ mol −1 , stabilare än transformen , med en energibarriär mot rotation på 45,3 kJ mol −1 . Cis- och transstrukturen har också bestämts med mikrovågsspektroskopi (se externa länkar).
 |

|
| cis -metylnitrit | trans -metylnitrit |
Syntes
Metylnitrit kan framställas genom reaktion mellan silvernitrit och jodmetan : Silvernitrit (AgNO 2 ) finns i lösning som silverjonen Ag + och nitritjonen NO 2 - . Ett av de ensamma paren på en syre från nitritjon angriper metylgruppen (—CH 3 ), och släpper ut jodidjonen i lösning. Till skillnad från silvernitrit är silverjodid mycket olösligt i vatten och bildar därmed ett fast ämne. Observera att kväve är en bättre nukleofil än syre och de flesta nitriter skulle reagera via en S N 2 -liknande mekanism och huvudprodukten skulle vara nitrometan . Till exempel natrium- och kaliumnitrit som reagerar med jodmetan producera mestadels nitrometan, med metylnitrit som den mindre produkten. Närvaron av silverjonen i lösning har emellertid en stabiliserande effekt på bildningen av karbokatjonintermediärer , vilket ökar det procentuella utbytet av metylnitrit. I båda fallen bildas en del nitrometan och metylnitrit.
Figuren visar de två gasfasstrukturerna av metylnitrit, bestämda med IR och mikrovågsspektroskopi.
Metylnitrit fri från nitrometan kan göras genom att reagera jodmetan med kvävedioxid :
Egenskaper och användningsområden
Metylnitrit är ett oxidationsmedel och ett värmekänsligt sprängämne; dess känslighet ökar i närvaro av metalloxider. Med oorganiska baser bildar den explosiva salter. Det bildar explosiva blandningar med luft. Det används som ett raketdrivmedel , ett monopropellant . Det exploderar häftigare än etylnitrit. Lägre alkylnitrit kan sönderdelas och spränga behållaren även när den förvaras i kyl.
Metylnitrit är en giftig kvävande gas, ett potent cyanotiskt medel. Exponering kan resultera i methemoglobinemi .
Metylnitrit produceras genom förbränning av blyfri bensin , och det har föreslagits som en möjlig orsak till nedgången av insekter , och därmed den för gråsparven och andra sångfåglar i Europa .
Metylnitrit finns också i åldrad cigarettrök. Här bildas den förmodligen av dikväveoxid (som själv bildas genom autooxidation av kväveoxid ) och metanol .
Metylnitrit används i kemisk syntes som prekursor och intermediär, t.ex. vid produktion av fenylpropanolamin .
Se även
Anförda källor
- Haynes, William M., red. (2011). CRC Handbook of Chemistry and Physics (92:a upplagan). CRC Tryck på . ISBN 978-1439855119 .

