Kalciumacetat
|
|
 Kalciumacetatkristaller
|
|
| Namn | |
|---|---|
|
Föredraget IUPAC-namn
Kalciumdiacetat |
|
| Andra namn Acetat av kalk Kalciumetanoat |
|
| Identifierare | |
|
3D-modell ( JSmol )
|
|
| Förkortningar | Ca(OAc) 2 |
| 3692527 | |
| ChEBI | |
| ChEMBL | |
| ChemSpider | |
| DrugBank | |
| ECHA InfoCard | 100.000.492 |
| EG-nummer |
|
| E-nummer | E263 (konserveringsmedel) |
| 22320 | |
| KEGG | |
|
PubChem CID
|
|
| RTECS-nummer |
|
| UNII |
|
|
CompTox Dashboard ( EPA )
|
|
|
|
|
|
| Egenskaper | |
| C4H6CaO4 _ _ _ _ _ _ | |
| Molar massa | 158,166 g-mol -1 |
| Utseende |
Vit fast hygroskopisk |
| Odör | lätt ättiksyralukt _ |
| Densitet | 1,509 g/cm 3 |
| Smältpunkt | 160 °C (320 °F; 433 K) sönderdelning till CaCO 3 + aceton |
|
37,4 g/100 ml (0 °C) 34,7 g/100 ml (20 °C) 29,7 g/100 ml (100 °C) |
|
| Löslighet | lätt löslig i metanol , hydrazin olöslig i aceton , etanol och bensen |
| Surhet (p K a ) | ca. 0,7 |
| -70,7·10 -6 cm3 / mol | |
|
Brytningsindex ( n D )
|
1,55 |
| Farmakologi | |
| V03AE07 ( WHO ) | |
| Faror | |
| NFPA 704 (branddiamant) | |
| 680 till 730 °C (1 256 till 1 346 °F; 953 till 1 003 K) | |
| Dödlig dos eller koncentration (LD, LC): | |
|
LD 50 ( mediandos )
|
4280 mg/kg (oral, råtta) |
| Besläktade föreningar | |
|
Andra katjoner
|
Magnesiumacetat |
|
Om inte annat anges ges data för material i standardtillstånd (vid 25 °C [77 °F], 100 kPa).
|
|
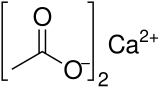
Kalciumacetat är en kemisk förening som är ett kalciumsalt av ättiksyra . Den har formeln Ca(C 2 H 3 O 2 ) 2 . Dess standardnamn är kalciumacetat, medan kalciumetanoat är det systematiska namnet. Ett äldre namn är acetat av kalk . Den vattenfria formen är mycket hygroskopisk ; därför är monohydratet (Ca(CH 3 COO) 2 • H 2 O ) den vanliga formen.
Produktion
Kalciumacetat kan framställas genom att blötlägga kalciumkarbonat (finns i äggskal eller i vanliga karbonatstenar som kalksten eller marmor ) eller hydratiserad kalk i vinäger :
- CaCO 3 (s) + 2CH 3 COOH (aq) → Ca(CH 3 COO) 2 (aq) + H 2 O(l) + CO 2 (g)
- Ca(OH) 2 (s) + 2CH 3 COOH(aq ) → Ca(CH3COO ) 2 ( aq) + 2H2O ( l)
Eftersom båda reagensen skulle ha varit tillgängliga förhistoriskt, skulle kemikalien ha varit observerbar som kristaller då.
Används
- Vid njursjukdom kan blodnivåerna av fosfat stiga (kallad hyperfosfatemi ) vilket leder till benproblem. Kalciumacetat binder fosfat i kosten för att sänka fosfatnivåerna i blodet.
- Kalciumacetat används som livsmedelstillsats , som stabilisator, buffert och bindemedel , främst i godisprodukter under numret E263.
- Tofu erhålls traditionellt genom att koagulera sojamjölk med kalciumsulfat . Kalciumacetat har visat sig vara ett bättre alternativ; eftersom det är lösligt kräver det mindre skicklighet och en mindre mängd.
- Eftersom det är billigt var kalciumacetat en gång ett vanligt utgångsmaterial för syntesen av aceton innan utvecklingen av kumenprocessen :
- Ca(CH 3 COO) 2 → CaCO 3 (s) + (CH 3 ) 2 CO
- En mättad lösning av kalciumacetat i alkohol bildar en halvfast, brandfarlig gel som är ungefär som "konserverad värme"-produkter som Sterno . Kemilärare förbereder ofta "California Snowballs", en blandning av kalciumacetatlösning och etanol . Den resulterande gelén är vitaktig till färgen och kan formas för att likna en snöboll .
Naturlig förekomst
Rent kalciumacetat är ännu okänt bland mineraler. Kalklacit - kalciumacetatkloridpentahydrat . - listas som ett känt mineral, men dess tillkomst är sannolikt antropogen (människan genererad, i motsats till naturligt förekommande) och den kan snart misskrediteras
- ^ International Union of Pure and Applied Chemistry (2014). Nomenklatur för organisk kemi: IUPAC-rekommendationer och föredragna namn 2013 . Royal Society of Chemistry . sid. 801. doi : 10.1039/9781849733069 . ISBN 978-0-85404-182-4 .
- ^ Dale L. Perry (19 maj 2011). Handbook of Inorganic Compounds (andra upplagan). Taylor och Francis. sid. 84. ISBN 978-1-4398-1461-1 .
- ^ "Kalciumacetat" . Mayo Clinic . Hämtad 19 november 2019 .
- ^ JY Lu, Eloise Carter och RA Chung (1980): "Use of Calcium Salts for Soybean Curd Preparation" Journal of Food Science , volym 45, nummer 1, sidorna 32–34 doi : 10.1111/j.1365-2621.1986.40. x
- ^ Leo Frank Goodwin; Edward Tyghe Sterne (1920). "Förluster vid framställning av aceton genom destillation av kalkacetat" . Industriell och teknisk kemi . 12 (3): 240–243. doi : 10.1021/ie50123a012 .
- ^ EGR Ardagh; AD Barbour; GE McClellan; EW McBride (1924). "Destillation av acetat av lime". Industriell och teknisk kemi . 16 (11): 1133–1139. doi : 10.1021/ie50179a013 .
- ^ "Canned Heat" på Journal of Chemical Education "Kemi kommer till liv!"
- ^ Kemiundervisningsresurser
- ^ "Calclacit" .
- ^ "Lista över mineraler" . 21 mars 2011.
