Ferredoxin—NADP(+)-reduktas
| ferredoxin-NADP+ | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| reduktasidentifierare | |||||||||
| EG nr. | 1.18.1.2 | ||||||||
| CAS-nr. | 9029-33-8 | ||||||||
| Databaser | |||||||||
| IntEnz | IntEnz-vy | ||||||||
| BRENDA | BRENDA inträde | ||||||||
| ExPASy | NiceZyme-vy | ||||||||
| KEGG | KEGG inträde | ||||||||
| MetaCyc | Metabolisk väg | ||||||||
| PRIAM | profil | ||||||||
| PDB- strukturer | RCSB PDB PDBe PDB summa | ||||||||
| Genontologi | AmiGO / QuickGO | ||||||||
| |||||||||
Inom enzymologi är ett ferredoxin-NADP + reduktas ( EC 1.18.1.2 ) förkortat FNR , ett enzym som katalyserar den kemiska reaktionen
- 2 reducerat ferredoxin + NADP + + H + 2 oxiderat ferredoxin + NADPH
De 3 substraten för detta enzym är reducerat ferredoxin , NADP + och H + , medan dess två produkter är oxiderat ferredoxin och NADPH . Den har en flavinkofaktor , FAD .
Detta enzym tillhör familjen oxidoreduktaser , som använder järn-svavelproteiner som elektrondonatorer och NAD + eller NADP + som elektronacceptorer.
Detta enzym deltar i fotosyntesen . FNR tillhandahåller en viktig källa till NADPH för fotosyntetiska organismer.
Nomenklatur
Det systematiska namnet på denna enzymklass är ferredoxin:NADP + oxidoreduktas. Andra namn i vanligt bruk inkluderar:
- adrenodoxinreduktas,
- ferredoxin-NADP + reduktas,
- ferredoxin-NADP + oxidoreduktas,
- ferredoxin-nikotinamid adenindinukleotidfosfatreduktas,
- ferredoxin-nikotinamid-adenindinukleotidfosfat (oxiderat), reduktas
- ferredoxin-TPN-reduktas,
- NADP + :ferredoxinoxidoreduktas,
- NADPH:ferredoxinoxidoreduktas,
- reducerad nikotinamid adenin dinukleotid fosfat-adrenodoxin, reduktas och
- TPNH-ferredoxinreduktas
Mekanism
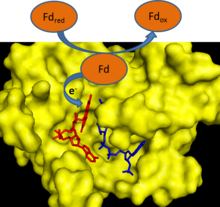
Under fotosyntesen avlägsnas elektroner från vattnet och överförs till den enskilda elektronbäraren ferredoxin . Ferredoxin: NADP + reduktas överför sedan en elektron från var och en av två ferredoxinmolekyler till en enda molekyl av två-elektronbäraren NADPH. FNR använder FAD , som kan existera i ett oxiderat tillstånd, enelektronreducerat semikinontillstånd och helt reducerat tillstånd för att förmedla denna elektronöverföring.
FNR har en inducerad passformsmekanism för katalys . Bindning av ferredoxin till enzymet orsakar bildandet av en vätebindning mellan en glutamatrest (E312) och en serinrest (S96) i det aktiva stället . Glutamatresten är mycket konserverad eftersom den både stabiliserar semikinonformen av FAD och är en protondonator/acceptor i reaktionen. Det hastighetsbegränsande steget för elektronöverföringsreaktionen är frisättningen av den första oxiderade ferredoxinmolekylen efter reduktionen av FAD med en elektron. Detta steg hämmas av närvaron av oxiderat ferredoxin och stimuleras av närvaron av NADP + . Bindningen av NADP + till enzymet sänker enzymets bindningsaffinitet för ferredoxin.
Denna reaktion kan också fungera omvänt för att generera reducerat ferredoxin, som sedan kan användas i en mängd olika biosyntetiska vägar. Vissa bakterier och alger använder molekylen flavodoxin istället för ferredoxin som den enda elektronbärarmolekylen som ska reduceras eller oxideras.
Strukturera
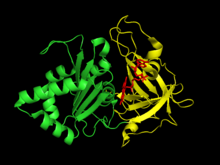
Ferredoxin av växttyp: NADP + reduktas har två strukturella domäner . Den första domänen är en antiparallell beta-cylinder vid aminoterminalen av proteinet som innehåller den bindande domänen för FAD-kofaktorn. Den andra domänen är vid proteinets karboxylterminal och innehåller en alfahelix - beta-strängveck . Denna terminala domän är där NADP + binder. Det aktiva stället för enzymet förekommer vid gränsytan mellan de två domänerna.
Bindning av enzymet till tylakoidmembranet involverar en polyprolin typ II helix skapad mellan två FNR-monomerer och flera prolinrika integrerade membranproteiner .
1QFY, I slutet av 2007 hade 54 strukturer lösts för denna klass av enzymer, med PDB- accessionskoderna 1B2R , 1BJK , 1BQE , 1BX0 , 1BX1 , 1CJC , 1E1L , 1E62 , 1E64 , 1E64 , 1E64 , 1E64 , 1E64 , 1E 1FNB , 1FNC , 1FND , 1FRN , 1FRQ , 1GAQ , 1GAW , 1GJR , 1GO2 , 1GR1 , 1H42 , 1H85 , 1JB9 , 1OGI , 1OGJ , 1QFY , 1QFZ 1QG0, , 1QGY, 1QGZ, 1QH0, 1QUE, 1QUF, 1SM4, 1W34, 1W35, 1W87, 2B5O, 2BGI, 2BGJ, 2BMW, 2BSA, 2C7G, 2GQW, 2GR0, 2GR1, 2GR2, 2GR3, 2OK7, and 2OK8.
Fungera
Ferredoxin: NADP + reduktas är det sista enzymet i överföringen av elektroner under fotosyntesen från fotosystem I till NADPH. NADPH används sedan som en reducerande ekvivalent i reaktionerna i Calvincykeln . Elektroncykling från ferredoxin till NADPH sker endast i ljuset delvis på grund av att FNR-aktiviteten hämmas i mörker. I icke-fotosyntetiska organismer fungerar FNR i första hand omvänt för att ge reducerat ferredoxin för olika metabola vägar . Dessa vägar inkluderar kvävefixering , terpenoidbiosyntes , steroidmetabolism , oxidativ stressrespons och biogenes av järn-svavelprotein.
FNR är ett lösligt protein som finns både fritt i kloroplaststroma och bundet till tylakoidmembranet. Denna bindning sker mitt emot enzymets aktiva ställe och verkar inte påverka strukturen på det aktiva stället eller ha en signifikant inverkan på enzymets aktivitet. När det är bundet till tylakoidmembranet existerar enzymet som en dimer, men när det är fritt i stroma är det monomert. Bindningen av FNR till de integrerade membranproteinerna på tylakoidmembranet förstärks under sura förhållanden, så rekrytering och bindning av FNR till tylakoidmembranet kan vara en metod för att lagra och stabilisera enzymet i mörker när fotosyntes inte sker. Kloroplaststroman varierar från att vara lätt sur i mörker till mer alkalisk i ljuset. Därför, i mörker, skulle fler FNR:er rekryteras och bindas till tylakoidmembranet, och i ljuset skulle fler FNR:er dissociera från membranet och vara fria i stroma.
Evolution
Ferredoxin NADP + reduktaser finns i många organismer, inklusive växter , bakterier och mitokondrierna hos eukaryoter. Dessa proteiner tillhör dock två obesläktade proteinfamiljer och är ett exempel på konvergent evolution . FNR:erna av växttyp ( InterPro : IPR015701 , InterPro : IPR033892 ) inkluderar de plastidiska FNR:er som ses i växter. FNR av glutation-reduktastyp ( InterPro : IPR022890 , InterPro : IPR021163 ) , ibland benämnd adrenodoxin-NADP+-reduktas för att särskilja sig, ses i eukaryoternas mitokondrier. Båda familjerna ses i bakterier. Två extra familjer, en tioredoxinreduktasliknande (TRLF) och den andra med en unik mekanism (NfnAB), har identifierats.
I den växtliknande familjen av FNR har selektivt evolutionärt tryck lett till skillnader i den katalytiska effektiviteten av FNR i fotosyntetiska och icke-fotosyntetiska organismer. Elektronöverföring genom FNR är ett hastighetsbegränsande steg i fotosyntesen, så den plastidiska FNR i växter har utvecklats till att vara mycket effektiv. Dessa plastidiska FNR är 20–100 gånger mer aktiva än bakteriella FNR. Denna högre katalytiska effektivitet för överföringen av elektroner från FAD till NADP + är relaterad till strukturella förändringar i det aktiva stället som minskar avståndet mellan N5 i FAD och C4 i NADP + . De plastidiska FNR:erna i växter har också utvecklats till att ha en hög grad av substratspecificitet för NADP + över NAD + ; studier av aminosyramutationer har visat att den terminala tyrosinresten i plastidiska FNR spelar en nyckelroll i denna substratspecificitet. Däremot binder vissa icke-fotosyntetiska FNR inte preferentiellt NADP + och saknar denna tyrosinrest.
Sjukdomsrelevans
Flera stora mänskliga sjukdomar orsakas av de obligatoriska intracellulära protozoparasiterna i phylum Apicomplexa . Apikoplastorganellen i dessa organismer tros ha kommit från en endosymbiotisk händelse där en förfäders protozo slukade en algcell . Dessa apikoplaster innehåller växtliknande FNR som protozoen använder för att generera reducerat ferredoxin , som sedan används som ett reduktionsmedel i väsentliga biosyntetiska vägar. FNR från två stora parasiter som påverkar människor, Plasmodium falciparum , som orsakar malaria , och Toxoplasma gondii , som orsakar toxoplasmos , har sekvenserats. Eftersom människor inte har ett homologt protein är dessa enzymer möjliga nya mål för läkemedelsbehandlingar mot dessa sjukdomar.
Vidare läsning
- Omura T, Sanders E, Estabrook RW, Cooper DY, Rosenthal O (1966). "Isolering från binjurebarken av ett nonheme järnprotein och ett flavoprotein funktionellt som ett reducerat trifosfopyridin nukleotid-cytokrom P-450 reduktas". Båge. Biochem. Biofys . 117 (3): 660–673. doi : 10.1016/0003-9861(66)90108-1 .
- Shin M, Tagawa K, Arnon DI (1963). "Kristallisering av ferredoxin-TPN-reduktas och dess roll i kloroplasternas fotosyntetiska apparat". Biochemische Zeitschrift . 338 : 84–96. PMID 14087348 .
externa länkar
-
 Media relaterade till Ferredoxin—NADP(+) reduktas på Wikimedia Commons
Media relaterade till Ferredoxin—NADP(+) reduktas på Wikimedia Commons