Cytokrom P450 reduktas
| NADPH | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| -hemoproteinreduktasidentifierare | |||||||||
| EG nr. | 1.6.2.4 | ||||||||
| CAS-nr. | 9023-03-4 | ||||||||
| Databaser | |||||||||
| IntEnz | IntEnz-vy | ||||||||
| BRENDA | BRENDA inträde | ||||||||
| ExPASy | NiceZyme-vy | ||||||||
| KEGG | KEGG inträde | ||||||||
| MetaCyc | Metabolisk väg | ||||||||
| PRIAM | profil | ||||||||
| PDB- strukturer | RCSB PDB PDBe PDB summa | ||||||||
| Genontologi | AmiGO / QuickGO | ||||||||
| |||||||||
| Cytokrom P450 | |
|---|---|
| reduktasidentifierare | |
| Symbol | CYPOR |
| InterPro | IPR023208 |
| Membran | 1072 |
Cytokrom P450-reduktas ( EC 1.6.2.4 ; även känd som NADPH:ferrihemoproteinoxidoreduktas, NADPH:hemoproteinoxidoreduktas, NADPH:P450-oxidoreduktas, P450-reduktas, POR , HLR, CYPOR) är ett nödvändigt för membran- till cytokromöverföring av enzym från NADPH P450 och andra hemproteiner inklusive hemoxygenas i den eukaryota cellens endoplasmatiska retikulum .
Fungera
I Bacillus megaterium och Bacillus subtilis är POR en C-terminal domän av CYP102, ett självförsörjande lösligt P450-system med en polypeptid (P450 är en N-terminal domän). Det allmänna schemat för elektronflöde i POR/P450-systemet är:
De definitiva bevisen för kravet på POR i cytokrom-P450-medierade reaktioner kom från arbetet av Lu, Junk och Coon, som dissekerade det P450-innehållande blandade oxidassystemet i tre beståndsdelar: POR, cytokrom P450 och lipider.
Eftersom alla mikrosomala P450-enzymer kräver POR för katalys, förväntas det att störningar av POR skulle få förödande konsekvenser. POR knockoutmöss är embryonala dödliga, troligen på grund av brist på elektrontransport till extrahepatiska P450-enzymer eftersom leverspecifik knockout av POR ger fenotypiskt och reproduktivt normala möss som ackumulerar leverlipider och har anmärkningsvärt minskad kapacitet för läkemedelsmetabolism i levern.
Reduktionen av cytokrom P450 är inte den enda fysiologiska funktionen av POR. Det sista steget av hemoxidation av däggdjurshemoxygenas kräver POR och O2 . I jäst påverkar POR ferrireduktasaktiviteten, vilket troligen överför elektroner till flavocytokrom ferri-reduktas.
Genorganisation
Human POR-gen har 16 exoner och exonerna 2-16 kodar för ett POR-protein med 677 aminosyror (NCBI NP_000932.2). Det finns en enda kopia av 50 kb POR-genen (NCBI NM_000941.2) hos människor på kromosom 7 (7q11.23).
Mutationer och polymorfismer
| POR | |||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | |||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||
| Identifierare | |||||||||||||||||||||||||||||||||||||||||||||||
| , HLR, CYP450R, cytokrom p450 oxidoreduktas, P450 oxidoreduktas | |||||||||||||||||||||||||||||||||||||||||||||||
| Externa ID:n | |||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||
| Wikidata | |||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||
Fem missense-mutationer (A287P, R457H, V492E, C569Y och V608F) och en splitsningsmutation i POR-generna har hittats hos patienter som hade hormonella bevis för kombinerade brister av två steroidogena cytokrom P450-enzymer - P450c17- steroider CYP17A hydroxylering och 17,20-lyasreaktion, och P450c21 21-hydroxylas , som katalyserar steroid 21-hydroxylering. En annan POR missense-mutation Y181D har också identifierats. Femton av nitton patienter med onormala könsorgan och störd steroidogenes var homozygota eller skenbara förening heterozygota för POR-mutationer som förstörde eller dramatiskt hämmade POR-aktivitet.
Mer än 200 variationer i POR-genen har identifierats.
POR-brist – blandad oxidassjukdom
POR-brist är den senaste formen av medfödd binjurehyperplasi som först beskrevs 2004. Indexpatienten var en nyfödd 46,XX japansk flicka med kraniosynostos, hypertelorism, hypoplasi i mitten av ansiktet, radiohumeral synostos, arachnodactyly och störd steroidogenes. De kliniska och biokemiska egenskaperna hos patienter med POR-brist är dock länge kända i litteraturen som så kallad blandad oxidassjukdom, eftersom POR-brist typiskt visar en steroidprofil som tyder på kombinerade brister av steroid 21-hydroxylas och 17α-hydroxylas/17, 20 lyasaktiviteter. Det kliniska spektrumet av POR-brist sträcker sig från allvarligt drabbade barn med tvetydiga könsorgan, binjurebarksvikt och Antley-Bixler skelettmissbildningssyndrom (ABS) till lindrigt drabbade individer med polycystiskt ovariesyndrom-liknande egenskaper. Några av POR-patienterna föddes av mödrar som blev viriliserade under graviditeten, vilket tyder på bristfällig placentaaromatisering av fosterandrogen på grund av en lesion i mikrosomalt aromatas vilket resulterade i låg östrogenproduktion, vilket senare bekräftades av lägre aromatasaktiviteter orsakade av POR-mutationer. Det har emellertid också föreslagits att foster- och maternell virilisering vid POR-brist kan orsakas av ökad dihydrotestosteronsyntes av fostrets gonad genom en alternativ " bakvägsväg " som först beskrevs i pungdjuren och senare bekräftades hos människor. Gaskromatografi/masspektrometrianalys av urinsteroider från gravida kvinnor som bär på ett foster med POR-brist som beskrivs i en tidigare rapport stöder också förekomsten av denna väg, och relevansen av bakdörrsvägen tillsammans med POR-beroende steroidogenes har blivit tydligare från nyare studier. Rollen för POR-mutationer utöver CAH undersöks; och frågor som hur POR-mutationer orsakar benavvikelser och vilken roll POR-varianter spelar i läkemedelsmetabolism av lever P450 behandlas i nya publikationer. Rapporter om ABS hos vissa avkommor till mödrar som behandlats med flukonazol, ett svampdödande medel som stör kolesterolbiosyntesen vid nivån av CYP51-aktivitet - indikerar att störd läkemedelsmetabolism kan bero på bristfällig POR-aktivitet.
Williams syndrom
Williams syndrom är en genetisk störning som kännetecknas av radering av genetiskt material cirka 1,2 Mb från POR-genen (POR). Celler med denna genetiska deletion visar minskad transkription av POR, det verkar, på grund av förlusten av ett cis-regulatoriskt element som förändrar uttrycket av denna gen. Vissa personer med Williams syndrom visar kännetecken på POR-brist, inklusive radioulnar synostos och andra skelettavvikelser. Fall av mild försämring av kortisol- och androgensyntesen har noterats, men trots att bristfällig POR försämrar androgensyntesen visar patienter med Williams syndrom ofta ökade androgennivåer. En liknande ökning av testosteron har observerats i en musmodell som globalt har minskat POR-uttryck.
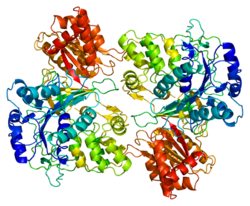
Strukturera
3D-kristallstrukturen för mänsklig POR har bestämts. Molekylen är sammansatt av fyra strukturella domäner: den FMN-bindande domänen, den anslutande domänen, den FAD-bindande domänen och NADPH-bindande domänen. Den FMN-bindande domänen liknar strukturen av FMN-innehållande proteinflavodoxin , medan den FAD-bindande domänen och NADPH-bindande domänerna liknar de för flavoprotein ferredoxin-NADP + reduktas (FNR). Den anslutande domänen är belägen mellan de flavodoxinliknande och FNR-liknande domänerna. Konformationsflexibilitet hos POR är ett nyckelkrav för interaktion med olika redoxpartners som Cytokrom P450-proteiner, och att påverka konformationen av POR med småmolekylära ligander kan vara ett sätt att kontrollera interaktion med partnerproteiner och påverka metabolismen.
POR-homologer
De andra enzymerna som innehåller homologer av POR är kväveoxidsyntas ( EC 1.14.13.39 ), NADPH:sulfitreduktas ( EC 1.8.1.2 ) och metioninsyntasreduktas ( EC 1.16.1.8 ).
Se även
externa länkar
- Cytokrom+P450+reduktas vid US National Library of Medicine Medical Subject Headings (MeSH)
- GeneReviews/NCBI/NIH/UW-post om Cytokrom P450 Oxidoreduktasbrist




