Karnitin O-acetyltransferas
| CRAT | |||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | |||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||
| Identifierare | |||||||||||||||||||||||||||||||||||||||||||||||
| , karnitin O-acetyltransferas, CAT1, CAT, NBIA8 | |||||||||||||||||||||||||||||||||||||||||||||||
| Externa ID:n | |||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||
| Wikidata | |||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||
Karnitin O-acetyltransferas även kallat karnitinacetyltransferas ( CRAT eller CAT ) ( EC 2.3.1.7 ) är ett enzym som kodas av CRAT-genen som katalyserar den kemiska reaktionen
- acetyl-CoA + karnitin CoA + acetylkarnitin
där acetylgruppen förskjuter väteatomen i den centrala hydroxylgruppen av karnitin.
Således är de två substraten för detta enzym acetyl-CoA och karnitin , medan dess två produkter är CoA och O- acetylkarnitin . Reaktionen är mycket reversibel och beror inte på i vilken ordning substrat binder.
Olika subcellulära lokaliseringar av CRAT-mRNA tros vara resultatet av alternativ splitsning av CRAT-genen som föreslås av de divergerande sekvenserna i 5'-regionen av peroxisomala och mitokondriella CRAT-cDNA och platsen för en intron där sekvenserna divergerar. Den alternativa splitsningen av denna gen resulterar i tre distinkta isoformer, varav en innehåller en N-terminal mitokondriell transitpeptid och har visats vara lokaliserad i mitokondrier.
Nomenklatur
Detta enzym tillhör familjen transferaser , för att vara specifikt de acyltransferaser som överför andra grupper än aminoacylgrupper. Det systematiska namnet på denna enzymklass är acetyl-CoA:karnitin O-acetyltransferas. Andra namn i vanlig användning inkluderar acetyl-CoA-karnitin O-acetyltransferas, acetylkarnitintransferas, karnitinacetylkoenzym A-transferas, karnitinacetylas, karnitinacetyltransferas, karnitin-acetyl-CoA-transferas och CATC. Detta enzym deltar i alanin- och aspartatmetabolismen.
Strukturera
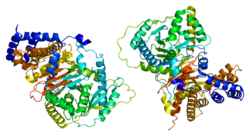
I allmänhet har karnitinacetyltransferaser molekylvikter på cirka 70 kDa och innehåller cirka 600 rester1. CRAT innehåller två domäner, en N-domän och en C-domän, och består av 20 α-helixar och 16 β-strängar. N-domänen består av ett åttasträngat β-ark flankerat på båda sidor av åtta a-helixar. Ett sexsträngat blandat β-ark och elva a-helixar utgör enzymets C-domän.
Vid jämförelse återspeglar kärnorna i de två domänerna signifikant liknande veckning av peptidryggraden. Detta sker trots att endast 4 % av aminosyrorna som utgör dessa peptidryggrader motsvarar varandra.
Aktiv sida
His343 är den katalytiska resten i CRAT. Den är belägen vid gränsytan mellan enzymets C- och N-domäner mot hjärtat av CRAT. His343 är tillgänglig via två 15-18 Å-kanaler som närmar sig resten från motsatta ändar av CRAT-enzymet. Dessa kanaler används av substraten för CRAT, en kanal för karnitin och en för CoA. Sidokedjan av His343 är placerad oregelbundet, med 5 1 -ringkvävet väte bundet till karbonylsyren på aminosyrastommen.
CoA-bindningsställe
På grund av det faktum att CRAT binder CoA, snarare än acetyl-CoA, verkar det som att CRAT har förmågan att hydrolysera acetyl-CoA, innan det interagerar med det ensamma CoA-fragmentet vid bindningsstället. CoA är bundet i en linjär konformation med dess pantoteniska armbindning vid det aktiva stället. Här bildar pantotenarmens terminala tiolgrupp och ε 2 -kvävet på den katalytiska His343-sidokedjan en vätebindning. 3'-fosfatet på CoA bildar interaktioner med resterna Lys419 och Lys423. Också vid bindningsstället bildar resterna Asp430 och Glu453 en direkt vätebindning till varandra. Om någon av resterna uppvisar en mutation, kan det resultera i en minskning av CRAT-aktiviteten.
Karnitinbindningsställe
Karnitin binder till CRAT i ett delvis veckat tillstånd, med dess hydroxylgrupp och karboxylgrupp vända mot motsatta riktningar. Själva stället är sammansatt av C-domänens p-arket och särskilda rester från N-domänen. Vid bindning lämnas en yta av karnitin exponerad för utrymmet utanför enzymet. Liksom CoA bildar karnitin en vätebindning med ε2-kvävet på His343. När det gäller karnitin bildas bindningen med dess 3-hydroxylgrupp. Denna CRAT-katalys är stereospecifik för karnitin, eftersom stereoisomeren av 3-hydroxylgruppen inte kan interagera tillräckligt med CRAT-karnitinbindningsstället. CRAT genomgår mindre konformationsförändringar vid bindning med karnitin.
Fungera
Enzymmekanism
| karnitin O-acetyltransferastransferasmekanism | |||||||||
|---|---|---|---|---|---|---|---|---|---|
 (His343)
| |||||||||
| Identifierare | |||||||||
| EG nr. | 2.3.1.7 | ||||||||
| CAS-nr. | 9029-90-7 | ||||||||
| Databaser | |||||||||
| IntEnz | IntEnz-vy | ||||||||
| BRENDA | BRENDA inträde | ||||||||
| ExPASy | NiceZyme-vy | ||||||||
| KEGG | KEGG inträde | ||||||||
| MetaCyc | Metabolisk väg | ||||||||
| PRIAM | profil | ||||||||
| PDB- strukturer | RCSB PDB PDBe PDB summa | ||||||||
| Genontologi | AmiGO / QuickGO | ||||||||
| |||||||||
His343-resten vid det aktiva stället för CRAT fungerar som en bas som kan deprotonera CoA-tiolgruppen eller Carnitine 3'-hydroxylgruppen beroende på reaktionsriktningen. Strukturen hos CRAT optimerar denna reaktion genom att orsaka direkt vätebindning mellan His343 och båda substraten. Den deprotonerade gruppen är nu fri att attackera acetylgruppen av acetyl-CoA eller acetylkarnitin vid dess karbonylställe. Reaktionen fortskrider direkt, utan bildning av en His343-acetyl-mellanprodukt.
Hydrolys
Det är möjligt för katalys att ske med endast ett av de två substraten. Om antingen acetyl-CoA eller acetylkarnitin binder till CRAT, kan en vattenmolekyl fylla det andra bindningsstället och fungera som en acetylgruppacceptor.
Substratassisterad katalys
Litteraturen tyder på att trimetylammoniumgruppen på karnitin kan vara en avgörande faktor vid CRAT-katalys. Denna grupp uppvisar en positiv laddning som stabiliserar oxyanjonen i reaktionens mellanprodukt. Denna idé stöds av det faktum att den positiva laddningen av karnitin är onödig för aktiv platsbindning, men avgörande för att katalysen ska fortsätta. Detta har visat sig vara fallet genom syntesen av en karnitinanalog som saknar sin trimetylammoniumgrupp. Denna förening kunde konkurrera med karnitin i bindning till CRAT, men kunde inte inducera en reaktion. Framväxten av subtratassisterad katalys har öppnat upp för nya strategier för att öka syntetiskt substratspecificitet.
Biologisk funktion
Det finns bevis som tyder på att CRAT-aktivitet är nödvändig för att cellcykeln ska gå från G1-fasen till S-fasen.
Klinisk signifikans
De med en ärftlig brist i CRAT-aktivitet löper risk att utveckla allvarliga hjärt- och neurologiska problem.
Minskad CRAT-aktivitet kan hittas hos individer som lider av Alzheimers sjukdom.
CRAT och dess familj av enzymer har stor potential som mål för att utveckla terapeutiska behandlingar för typ 2-diabetes och andra sjukdomar.
Interaktioner
CRAT är känt för att interagera med NEDD8 , PEX5 , SUMO1 .
Vidare läsning
- Chase JF, Pearson DJ, Tubbs PK (januari 1965). "Framställningen av Crystallin Carnitine Acetyltransferase". Biochimica et Biophysica Acta (BBA) - Nukleinsyror och proteinsyntes . 96 : 162–5. doi : 10.1016/0005-2787(65)90622-2 . PMID 14285260 .
- Friedman S, Fraenkel G (dec 1955). "Reversibel enzymatisk acetylering av karnitin". Arkiv för biokemi och biofysik . 59 (2): 491–501. doi : 10.1016/0003-9861(55)90515-4 . PMID 13275966 .
- Miyazawa S, Ozasa H, Furuta S, Osumi T, Hashimoto T (feb 1983). "Rening och egenskaper hos karnitinacetyltransferas från råttlever". Journal of Biochemistry . 93 (2): 439–51. doi : 10.1093/oxfordjournals.jbchem.a134198 . PMID 6404901 .
]






