Acetoacetatdekarboxylas
| Acetoacetatdekarboxylas | |||||||||
|---|---|---|---|---|---|---|---|---|---|
 Acetoacetatdekarboxylasdodekamerstruktur med bunden 2-Pentanon bunden i dess aktiva ställen .
| |||||||||
| Identifierare | |||||||||
| EG nr. | 4.1.1.4 | ||||||||
| CAS-nr. | 9025-03-0 | ||||||||
| Databaser | |||||||||
| IntEnz | IntEnz-vy | ||||||||
| BRENDA | BRENDA inträde | ||||||||
| ExPASy | NiceZyme-vy | ||||||||
| KEGG | KEGG inträde | ||||||||
| MetaCyc | Metabolisk väg | ||||||||
| PRIAM | profil | ||||||||
| PDB- strukturer | RCSB PDB PDBe PDB summa | ||||||||
| Genontologi | AmiGO / QuickGO | ||||||||
| |||||||||
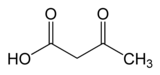
Acetoacetatdekarboxylas ( AAD eller ADC ) är ett enzym ( EC 4.1.1.4 ) involverat i både ketonkroppsproduktionsvägen hos människor och andra däggdjur, och lösningsbildning i bakterier. Acetoacetatdekarboxylas spelar en nyckelroll i lösningsmedelsproduktionen genom att katalysera dekarboxyleringen av acetoacetat, vilket ger aceton och koldioxid .
Detta enzym har varit av särskilt intresse eftersom det är ett klassiskt exempel på hur pKa- värden för joniserbara grupper i det aktiva enzymstället kan störas avsevärt. Specifikt är pKa-värdet för lysin 115 i det aktiva stället ovanligt lågt, vilket möjliggör bildning av en Schiff-basmellanprodukt och katalys.
| acetoättiksyra | Acetoacetatdekarboxylas | aceton | |
|

|
||
| CO 2 | |||

|
|||
Historia
Acetoacetatdekarboxylas är ett enzym med stora historiska implikationer, särskilt i första världskriget och i etableringen av staten Israel . Under kriget behövde de allierade rent aceton som lösningsmedel för nitrocellulosa , en mycket brandfarlig förening som är huvudkomponenten i krut. År 1916 var biokemisten och den framtida förste presidenten för Israel Chaim Weizmann den förste att isolera Clostridium acetobutylicum , en grampositiv , anaerob bakterie i vilken acetoacetatdekarboxylas finns. Weizmann kunde utnyttja organismens förmåga att ge aceton från stärkelse för att massproducera sprängämnen under kriget. Detta ledde till att de amerikanska och brittiska regeringarna installerade processen som utformats av Chaim Weizmann i flera stora anläggningar i England, Frankrike, Kanada och USA. Genom Weizmanns vetenskapliga bidrag under första världskriget kom han nära inflytelserika brittiska ledare som utbildade dem om hans sionistiska övertygelse. En av dem var Arthur Balfour, mannen som Balfourdeklarationen – det första dokumentet som uttalade brittiskt stöd för upprättandet av ett judiskt hemland – döptes efter.
Produktionen av aceton av acetoacetatdekarboxylas-innehållande eller klostridiumbakterier användes i storskaliga industriella synteser under första hälften av 1900-talet. På 1960-talet ersatte industrin denna process med billigare, mer effektiva kemiska synteser av aceton från petroleum och petroleumderivat. Det har dock funnits ett växande intresse för acetonproduktion som är mer miljövänlig, vilket orsakar ett återuppsving i användningen av acetoacetatdekarboxylasinnehållande bakterier. På liknande sätt blir isopropanol- och butanoljäsning med användning av klostridiumarter också populär.
Strukturera
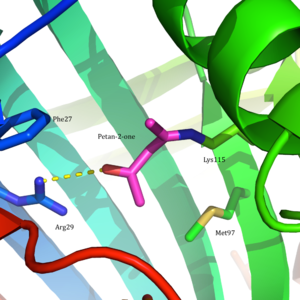
Acetoacetatdekarboxylas är ett 365 kDa komplex med en homododecamerisk struktur. Den övergripande strukturen består av antiparallella β-skivor och en central sju-strängad konformad β-pipa . Kärnan i denna β-fat omger det aktiva stället i varje protomer av enzymet. Det aktiva stället, bestående av rester såsom Phe27 , Met97 och Tyr113 , är mestadels hydrofobt . Det aktiva stället innehåller emellertid två laddade rester: Arg29 och Glu76 .
Arg29 tros spela en roll i substratbindning, medan Glu76 tros spela en roll i orienteringen av det aktiva stället för katalys. Den övergripande hydrofoba miljön för det aktiva stället spelar en kritisk roll för att gynna den neutrala aminformen av Lys115, en nyckelrest som är involverad i bildandet av en Schiff-basintermediär . En annan viktig lysinrest, Lys116, tros spela en viktig roll i positioneringen av Lys115 i det aktiva stället. Genom vätebindningar med Ser16 och Met210 positionerar Lys116 Lys115 i den hydrofoba fickan på det aktiva stället för att gynna den neutrala aminformen.
Reaktionsmekanism
Acetoacetatdekarboxylas från Clostridium acetobutylicum katalyserar dekarboxyleringen av acetoacetat för att ge aceton och koldioxid (Figur 1). Reaktionsmekanismen fortskrider via bildningen av en Schiff-basintermediär , som är kovalent bunden till lysin 115 i det aktiva stället. Den första raden av stöd för denna mekanism kom från ett radiomärkningsexperiment där forskare märkte karbonylgruppen i acetoacetat med 18 O och observerade att syreutbyte till vatten, som används som lösningsmedel, är en nödvändig del av dekarboxyleringssteget. Dessa resultat gav stöd för att mekanismen fortskrider genom en Schiff-basmellanprodukt mellan ketoasyran och en aminosyrarest på enzymet.
Ytterligare forskning ledde till isolering av en peptidsekvens på det aktiva stället och identifiering av lysinet på det aktiva stället, Lys115, som är involverat i bildandet av Schiff-basintermediären. Dessutom ledde senare experiment till upptäckten att maximal aktivitet av enzymet inträffar vid pH 5,95, vilket tyder på att pKa för e-ammoniumgruppen i Lys115 är signifikant störd i det aktiva stället. Om pKa inte stördes nedåt, skulle lysinresten förbli protonerad som en ammoniumkatjon, vilket gör den oreaktiv för den nukleofila tillsatsen som är nödvändig för att bilda Schiff-basen.
Med utgångspunkt i denna upptäckt, Westheimer et al. mätte direkt pKa för Lys115 i det aktiva stället med användning av 5-nitrosalicylaldehyd (5-NSA). Reaktion av 5-NSA med acetoacetatdekarboxylas och efterföljande reduktion av den resulterande Schiff-basen med natriumborhydrid ledde till införlivandet av en 2-hydroxi-5-nitrobensylaminoreportermolekyl i det aktiva stället (Figur 2). Titrering av enzymet med denna bifogade rapportörgrupp avslöjade att pKa för Lys115 minskade till 5,9 i det aktiva stället. Dessa resultat låg till grund för förslaget att störningen i pKa av Lys115 berodde på dess närhet till den positivt laddade e-ammoniumgruppen av Lys116 i det aktiva stället. En närliggande positiv laddning kan orsaka ogynnsamma elektrostatiska repulsioner som försvagar NH-bindningen av Lys115. Westheimer et al.s förslag stöddes ytterligare av platsriktade mutagenesstudier . När Lys116 muterades till cystein eller asparagin , visade sig pKa för Lys115 vara signifikant förhöjd till över 9,2, vilket indikerar att positivt laddat Lys116 spelar en kritisk roll för att bestämma pKa för Lys115. Även om en kristallstruktur ännu inte var löst för att ge strukturella bevis, accepterades detta förslag allmänt och citerades som ett läroboksexempel på hur den aktiva platsen kan organiseras exakt för att störa en pKa och påverka reaktiviteten.
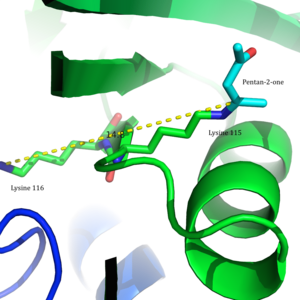
2009 löstes en kristallstruktur av acetoacetatdekarboxylas från Clostridium acetobutylicum , vilket gjorde att Westheimer et al.s förslag kunde utvärderas ur ett nytt perspektiv. Från kristallstrukturen fann forskarna att Lys 115 och Lys 116 är orienterade i motsatta riktningar och åtskilda av 14,8 Å (Figur 3). Detta avstånd gör det osannolikt att den positiva laddningen av Lys116 kan påverka pKa för Lys115. Istället genom vätebindningar med Ser16 och Met210, håller Lys116 sannolikt Lys115 på plats i en hydrofob ficka av det aktiva stället. Denna positionering stör stabiliteten hos den protonerade ammoniumkatjonen av Lys115, vilket tyder på att störningen av Lys115s pKa sker genom en " desolvationseffekt ".
Inaktivering och hämning
Acetoacetatdekarboxylas hämmas av ett antal föreningar. Ättiksyraanhydrid utför en elektrofil attack på den kritiska katalytiska resten, Lys115, av acetoacetatdekarboxylas för att inaktivera enzymet. Inaktiveringshastigheten bestämdes genom hydrolys av det syntetiska substratet 2,4-dinitrofenylpropionat till dinitrofenol med acetoacetatdekarboxylas. I närvaro av ättiksyraanhydrid inaktiveras enzymet och kan inte katalysera hydrolysreaktionen 2,4-dinitrofenylpropionat till dinitrofenol.
Acetonylsulfonat fungerar som en kompetitiv inhibitor (K I = 8,0 mM ) eftersom det efterliknar egenskaperna hos det naturliga substratet, acetoacetat (K M = 8,0 mM). Monoanjonversionen av acetonylfosfonat är också en bra inhibitor (K I = 0,8 mM), mer effektiv än acetonylfosfonatmonoestern eller dianjonen. Dessa fynd indikerar att aktiv plats är mycket diskriminerande och steriskt begränsad.
Vätecyanid verkar vara en icke-kompetitiv hämmare , kombinerad med Schiffs basföreningar som bildas på det aktiva stället. Tillsats av karbonylföreningar till enzymet, i närvaro av vätecyanid, ökar vätecyanids förmåga att hämma acetoacetatdekarboxylas, vilket tyder på att karbonylföreningar lätt bildar Schiffs baser vid det aktiva stället. Vätecyanid är mest potent som en inhibitor vid pH 6, det optimala pH-värdet för enzymet, vilket tyder på att det hastighetsbegränsande steget i katalys är bildandet av Schiff-basmellanprodukten.
Beta-diketoner verkar hämma acetoacetatdekarboxylas bra men långsamt. Acetoacetatdekarboxylas har ett K M för acetoacetat på 7×10 −3 M medan enzymet har ett K I för bensoylaceton på 1,9×10 −6 M. En enamin bildas med största sannolikhet vid interaktion av beta-diketoner med fritt enzym.
Reaktionen av acetoacetatdekarboxylas med p -klormerkurifenylsulfonat (CMS) resulterar i minskad katalytisk aktivitet på två ekvivalenter CMS per enzymsubenhet. CMS interagerar med två sulfhydrylgrupper belägna på varje enzymsubenhet. Ytterligare inaktivering sker vid tillsats av en tredje ekvivalent CMS per subenhet. Tillsats av fritt cystein till det hämmade enzymet kan vända CMS-hämningen av acetoacetatdekarboxylas.
Aktivitet hos bakterier
Acetoacetatdekarboxylas har hittats och studerats i följande bakterier förutom Clostridium acetobutylicum :
- Bacillus polymyxa
- Chromobacterium violaceum
- Clostridium beijerinckii
- Clostridium cellulolyticum
- Pseudomonas putida
Aktivitet hos människor och däggdjur
Även om detta enzym inte har renats från mänsklig vävnad, visades aktiviteten vara närvarande i humant blodserum.
Hos människor och andra däggdjur är omvandlingen av acetoacetat till aceton och koldioxid genom acetoacetatdekarboxylas ett sista irreversibelt steg i keton-kroppsvägen som förser kroppen med en sekundär energikälla. I levern omvandlas acetyl co-A som bildas av fetter och lipider till tre ketonkroppar: aceton , acetoacetat och D-β-hydroxibutyrat . Acetoacetat och D-β-hydroxibutyrat exporteras till icke-hepatiska vävnader, där de omvandlas tillbaka till acetyl-coA och används som bränsle. Aceton och koldioxid å andra sidan andas ut och får inte ansamlas under normala förhållanden.
Acetoacetat och D-β-hydroxibutyrat omvandlas fritt genom verkan av D-β-hydroxibutyratdehydrogenas. Därefter kan en funktion av acetoacetatdekarboxylas vara att reglera koncentrationerna av de andra två ketonkropparna med 4 kol.
Klinisk signifikans
Ketonproduktionen ökar avsevärt när glukosmetabolismens hastighet är otillräcklig för att tillgodose kroppens energibehov. Sådana tillstånd inkluderar ketogen dieter med hög fetthalt, diabetisk ketoacidos eller svår svält.
Under förhöjda nivåer av acetoacetat och D-β-hydroxibutyrat producerar acetoacetatdekarboxylas betydligt mer aceton. Aceton är giftigt och kan ackumuleras i kroppen under dessa förhållanden. Förhöjda nivåer av aceton i människans andetag kan användas för att diagnostisera diabetes.
externa länkar
- acetoacetat+dekarboxylas vid US National Library of Medicine Medical Subject Headings (MeSH)
- EC 4.1.1.4
- Brenda: Inträde av acetoacetatdekarboxylas
- KEGG: Inträde av acetoacetatdekarboxylas
- InterPro: IPR010451 Acetoacetatdekarboxylas

