2-hydroxi-dATP difosfatas
| 2-hydroxi-dATP | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| difosfatasidentifierare | |||||||||
| EG nr. | 3.6.1.56 | ||||||||
| Databaser | |||||||||
| IntEnz | IntEnz-vy | ||||||||
| BRENDA | BRENDA inträde | ||||||||
| ExPASy | NiceZyme-vy | ||||||||
| KEGG | KEGG inträde | ||||||||
| MetaCyc | Metabolisk väg | ||||||||
| PRIAM | profil | ||||||||
| PDB- strukturer | RCSB PDB PDBe PDB summa | ||||||||
| |||||||||
2-hydroxi-dATP difosfatas ( EC 3.6.1.56 , även känd som oxiderat purinnukleosidtrifosfatas, eller (2'-deoxi) ribonukleosid 5'-trifosfat pyrofosfohydrolas, eller Nudix hydrolas 1 (NUDT1), 1 (NUDT1), eller eller 7,8-dihydro-8-oxoguanintrifosfatas) är ett enzym som hos människor kodas av NUDT1- genen . Under DNA-reparation hydrolyserar enzymet oxiderade puriner och förhindrar att de adderas till DNA-kedjan. Som sådan har den en viktig roll i åldrande och cancerutveckling.
Fungera
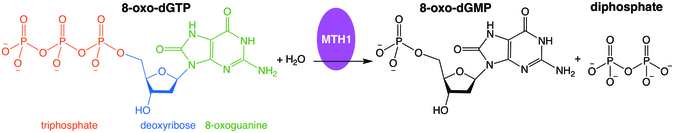
Detta enzym katalyserar följande kemiska reaktion
- 2-hydroxi-dATP + H 2 O 2-hydroxi-dAMP + difosfat
Enzymet hydrolyserar oxiderade purinnukleosidtrifosfater . Enzymet används vid DNA-reparation, där det hydrolyserar de oxiderade purinerna och förhindrar att de adderas till DNA-kedjan.
Felinkorporering av oxiderade nukleosidtrifosfater i DNA och/eller RNA under replikering och transkription kan orsaka mutationer som kan resultera i karcinogenes eller neurodegeneration . Först isolerades från Escherichia coli på grund av dess förmåga att förhindra förekomst av 8-oxoguanin i DNA, proteinet som kodas av denna gen är ett enzym som hydrolyserar oxiderade purinnukleosidtrifosfater , såsom 8-oxo-dGTP, 8-oxo-dATP, 2 -oxo-dATP, 2-hydroxi-dATP och 2-hydroxi-rATP, till monofosfater, vilket förhindrar felaktig inkorporering.
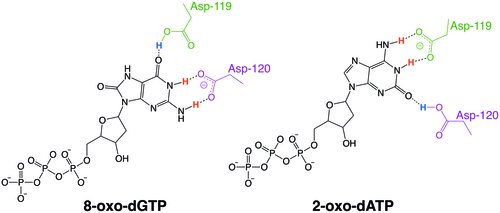
MutT-enzymer i icke-humana organismer har ofta substratspecificitet för vissa typer av oxiderade nukleotider, såsom den hos E. coli , som är specifik för 8-oxoguanin-nukleotider. Human MTH1 har emellertid substratspecificitet för ett mycket bredare spektrum av oxidativt skadade nukleotider. Mekanismen för hMTH1:s breda specificitet för dessa oxiderade nukleotider härleds från deras igenkänning i enzymets substratbindningsficka på grund av ett utbyte av protonationstillstånd mellan två närliggande aspartatrester.
Det kodade proteinet är lokaliserat huvudsakligen i cytoplasman , med en del i mitokondrierna , vilket tyder på att det är involverat i saneringen av nukleotidpooler både för nukleära och mitokondriella genom. I växter har MTH1 också visat sig öka motståndskraften mot värme- och parakvatinducerad oxidativ stress, vilket resulterar i färre döda celler och mindre ackumulering av väteperoxid .
Flera alternativt splitsade transkriptvarianter, av vilka några kodar för distinkta isoformer , har identifierats. Ytterligare varianter har observerats, men deras fullängdsnatur har inte fastställts. En enkelnukleotidpolymorfism som resulterar i produktionen av ytterligare en längre isoform har beskrivits.
Forskning
Åldrande
En musmodell har studerats som överuttrycker hMTH1-Tg (NUDT1). hMTH1-Tg-mössen uttrycker höga nivåer av hMTH1- hydrolaset som bryter ned 8-oxodGTP och 8-oxoGTP och därför utesluter 8-oxoguanin från DNA och RNA . Steady state-nivåerna av 8-oxoguanin i DNA från flera organ inklusive hjärnan reduceras signifikant i hMTH1-Tg-överuttryckande möss. Omvänt uppvisar MTH1-nullmöss en signifikant högre nivå av 8-oxo-dGTP-ackumulering än den för vildtypen. Överuttryck av hMTH1 förhindrar den åldersberoende ackumuleringen av DNA 8-oxoguanin som förekommer i vildtypsmöss. De lägre nivåerna av oxiderade guaniner är förknippade med längre livslängd . hMTH1-Tg-djuren har en betydligt längre livslängd än deras vildtypskullkamrater. Dessa fynd ger en koppling mellan åldrande och oxidativ DNA-skada (se DNA-skadeteori om åldrande) .
Cancer
Studier har föreslagit att detta enzym spelar en roll både för att förhindra bildandet av cancerceller och spridningen av cancerceller. Detta gör det till ett ämne av intresse för cancerforskning , både som en potentiell metod för friska celler att förebygga cancer och som en svaghet att rikta in sig på inom befintliga cancerceller.
Att eliminera MTH1-genen hos möss resulterar i att över tre gånger fler möss utvecklar tumörer jämfört med en kontrollgrupp . Enzymets mycket studerade förmåga att sanera en cells nukleotidpool hindrar den från att utveckla mutationer, inklusive cancersjukdomar. Specifikt fann en annan studie att MTH1- hämning i cancerceller leder till inkorporering av 8-oxo-dGTP och andra oxidativt skadade nukleotider i cellens DNA, skadar den och orsakar celldöd. Men cancerceller har också visat sig dra nytta av användningen av MTH1. Celler från maligna brösttumörer uppvisar extremt MTH1-uttryck jämfört med andra mänskliga celler. Eftersom en cancercell delar sig mycket snabbare än en normal mänsklig cell, är den mycket mer i behov av ett enzym som MTH1 som förhindrar dödliga mutationer under replikering. Denna egenskap hos cancerceller kan möjliggöra övervakning av cancerbehandlingens effektivitet genom att mäta MTH1-uttryck. Utveckling av lämpliga sonder för detta ändamål pågår för närvarande.
Oenighet råder om MTH1:s funktion i förhållande till förebyggande av DNA-skador och cancer. Efterföljande studier har haft svårt att reproducera tidigare rapporterade cytotoxiska eller antiproliferationseffekter av MTH1-hämning på cancerceller, till och med ifrågasatt om MTH1 verkligen tjänar till att ta bort oxidativt skadade nukleotider från en cells nukleotidpool. En studie av nyupptäckta MTH1-hämmare tyder på att dessa anticanceregenskaper som uppvisas av de äldre MTH1-hämmarna kan bero på cytotoxiska effekter utanför målet. Efter att ha återbesökt experimentet fann de ursprungliga författarna till detta påstående att även om de ursprungliga MTH1-hämmarna i fråga leder till att skadade nukleotider införlivas i DNA, visar de att de andra som inte inducerar toxicitet misslyckas med att introducera DNA-skadan. Forskning om detta ämne pågår.
Som ett drogmål
MTH1 är ett potentiellt läkemedelsmål för att behandla cancer, men det finns motstridiga resultat när det gäller cytotoxiciteten hos MTH1-hämmare mot cancerceller.
Karonudib, en MTH1-hämmare, utvärderas för närvarande i en klinisk fas I- studie för säkerhet och tolerabilitet.
En potent och selektiv MTH1-hämmare AZ13792138 har utvecklats av AstraZeneca och har gjorts tillgänglig som en kemisk sond för akademiska forskare. AstraZeneca har dock funnit att varken AZ13792138 eller genetisk knockdown av MTH1 uppvisar någon signifikant cytotoxicitet för cancerceller.
Se även
Vidare läsning
- Furuichi M, Yoshida MC, Oda H, Tajiri T, Nakabeppu Y, Tsuzuki T, Sekiguchi M (december 1994). "Genomisk struktur och kromosomplacering av den humana mutT-homologgenen MTH1 som kodar för 8-oxo-dGTPas för förhindrande av A:T till C:G-transversion". Genomik . 24 (3): 485–90. doi : 10.1006/geno.1994.1657 . PMID 7713500 .
- Kang D, Nishida J, Iyama A, Nakabeppu Y, Furuichi M, Fujiwara T, Sekiguchi M, Takeshige K (juni 1995). "Intracellulär lokalisering av 8-oxo-dGTPas i mänskliga celler, med särskild hänvisning till enzymets roll i mitokondrier" . Journal of Biological Chemistry . 270 (24): 14659–65. doi : 10.1074/jbc.270.24.14659 . PMID 7782328 .
- Oda H, Nakabeppu Y, Furuichi M, Sekiguchi M (juli 1997). "Reglering av uttryck av den humana MTH1-genen som kodar för 8-oxo-dGTPas. Alternativ splitsning av transkriptionsprodukter" . Journal of Biological Chemistry . 272 (28): 17843–50. doi : 10.1074/jbc.272.28.17843 . PMID 9211940 .
- Oda H, Taketomi A, Maruyama R, Itoh R, Nishioka K, Yakushiji H, Suzuki T, Sekiguchi M, Nakabeppu Y (november 1999). "Multiformer av humana MTH1-polypeptider producerade genom alternativ translationsinitiering och enkelnukleotidpolymorfism" . Nukleinsyraforskning . 27 (22): 4335–43. doi : 10.1093/nar/27.22.4335 . PMC 148714 . PMID 10536140 .
- Sakai Y, Furuichi M, Takahashi M, Mishima M, Iwai S, Shirakawa M, Nakabeppu Y (mars 2002). "En molekylär grund för selektivt igenkännande av 2-hydroxi-dATP och 8-oxo-dGTP av humant MTH1" . Journal of Biological Chemistry . 277 (10): 8579–87. doi : 10.1074/jbc.M110566200 . PMID 11756418 .
- Fujikawa K, Yakushiji H, Nakabeppu Y, Suzuki T, Masuda M, Ohshima H, Kasai H (februari 2002). "8-Chloro-dGTP, en hypoklorsyramodifierad nukleotid, hydrolyseras av hMTH1, den humana MutT-homologen" . FEBS Bokstäver . 512 (1–3): 149–51. doi : 10.1016/S0014-5793(02)02240-8 . PMID 11852070 .
- Topp H, Armbrust S, Lengger C, Schöch G, Davies J, Stichler W, Manz F, Fusch C (juni 2002). "Njurutsöndring av 8-oxo-7,8-dihydro-2(')-deoxiguanosin: nedbrytningshastigheter av RNA och metabolisk hastighet hos människor". Arkiv för biokemi och biofysik . 402 (1): 31–7. doi : 10.1016/S0003-9861(02)00034-6 . PMID 12051680 .
- Takahashi M, Maraboeuf F, Sakai Y, Yakushiji H, Mishima M, Shirakawa M, Iwai S, Hayakawa H, Sekiguchi M, Nakabeppu Y (maj 2002). "Roll av tryptofanrester i igenkännandet av mutagena oxiderade nukleotider av humant antimutator MTH1-protein". Journal of Molecular Biology . 319 (1): 129–39. doi : 10.1016/S0022-2836(02)00163-8 . PMID 12051941 .
- Liu Z, Wang LE, Strom SS, Spitz MR, Babaian RJ, DiGiovanni J, Wei Q (mars 2003). "Överuttryck av hMTH i perifera lymfocyter och risk för prostatacancer: en fallkontrollanalys". Molekylär karcinogenes . 36 (3): 123–9. doi : 10.1002/mc.10108 . PMID 12619034 . S2CID 26364277 .
- Ishibashi T, Hayakawa H, Sekiguchi M (maj 2003). "En ny mekanism för att förhindra mutationer orsakade av oxidation av guaninukleotider" . EMBO-rapporter . 4 (5): 479–83. doi : 10.1038/sj.embor.embor838 . PMC 1319193 . PMID 12717453 .
- Kennedy CH, Pass HI, Mitchell JB (juni 2003). "Uttryck av humant MutT homolog (hMTH1) protein i primära icke-småcelliga lungkarcinom och histologiskt normal omgivande vävnad". Fri radikal biologi och medicin . 34 (11): 1447–57. doi : 10.1016/S0891-5849(03)00176-X . PMID 12757855 .
- Yoshimura D, Sakumi K, Ohno M, Sakai Y, Furuichi M, Iwai S, Nakabeppu Y (september 2003). "Ett oxiderat purinnukleosidtrifosfatas, MTH1, undertrycker celldöd orsakad av oxidativ stress" . Journal of Biological Chemistry . 278 (39): 37965–73. doi : 10.1074/jbc.M306201200 . PMID 12857738 .
- Kamiya H, Dugué L, Yakushiji H, Pochet S, Nakabeppu Y, Harashima H (2003). "Substratigenkänning av det humana MTH1-proteinet" . Nukleinsyraforskning. Tillägg . 2 (2): 85–6. doi : 10.1093/nass/2.1.85 . PMID 12903117 .
- Bialkowski K, Kasprzak KS (september 2003). "Hämning av 8-oxo-2'-deoxiguanosin 5'-trifosfatpyrofosfohydrolas (8-oxo-dGTPas) aktivitet av det antimutagena humana MTH1-proteinet av nukleosid 5'-difosfater". Fri radikal biologi och medicin . 35 (6): 595–602. doi : 10.1016/S0891-5849(03)00362-9 . PMID 12957652 .
- Kamiya H, Yakushiji H, Dugué L, Tanimoto M, Pochet S, Nakabeppu Y, Harashima H (februari 2004). "Undersöka substratigenkänningsmekanismen för det humana MTH1-proteinet med nukleotidanaloger". Journal of Molecular Biology . 336 (4): 843–50. doi : 10.1016/j.jmb.2003.12.060 . PMID 15095864 .
- Lowe, Derek (7 juli 2017). "MTH1: Från hett ämne till devalidering?" . Vetenskap translationell medicin . American Association for the Advancement of Science . Hämtad 19 juli 2017 .
- Workman, Paul (10 juli 2017). "Ring till biovetare: välj och använd dina kemiska sonder mycket noggrant" . Institutet för cancerforskning, London . Institutet för cancerforskning . Hämtad 19 juli 2017 .
externa länkar
- 2-hydroxi-dATP+difosfatas vid US National Library of Medicine Medical Subject Headings (MeSH)