1,3-difenylisobensofuran
|
|

|
|
| Namn | |
|---|---|
|
Föredraget IUPAC-namn
1,3-difenyl-2-bensofuran |
|
| Identifierare | |
| ChemSpider | |
| ECHA InfoCard | 100.024.371 |
|
PubChem CID
|
|
| UNII | |
|
CompTox Dashboard ( EPA )
|
|
| Egenskaper | |
| C20H14O _ _ _ _ | |
| Molar massa | 270,33 g· mol -1 |
| Utseende | blekgult till mörkgult kristallint pulver |
| Densitet | 1,0717 g·cm -3 vid 25 °C |
| Smältpunkt | * 125–126 °C
|
| nästan olöslig | |
| Löslighet i acetonitril , bensen , diklormetan , kloroform , dimetylsulfoxid , tetrahydrofuran eller toluen | löslig |
|
Om inte annat anges ges data för material i standardtillstånd (vid 25 °C [77 °F], 100 kPa).
|
|
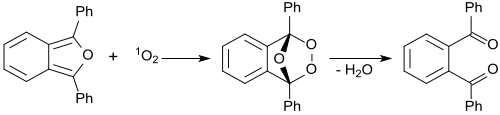
1,3-Diphenylisobenzofuran är en mycket reaktiv dien som kan avlägsna instabila och kortlivade dienofiler i en Diels-Alder-reaktion . Det används dessutom som ett standardreagens för bestämning av singlettsyre , även i biologiska system. Cycladditioner med 1,3-difenylisobensofuran och efterföljande syreklyvning ger tillgång till en mängd olika polyaromater .
Förberedelse
Den första syntesen av 1,3-difenylisobensofuran rapporterades 1905 av A. Guyot och J. Catel. Fenylmagnesiumbromid omsattes med 3-fenylftalid (den senare tillgänglig från metylestern av 3-hydroxiftalid med fenylboronsyra i 95 % utbyte) till en laktol , som ger med mineralsyror vid eliminering av vatten 1,3-difenylisobensofuranyld med 1,3 .
Patentlitteraturen beskriver framställningen av 1,3-difenylisobensofuran genom [4+2]cykloaddition av 1,3-butadien och dibensoyletylen (1,4-difenyl-2-buten-1,4-dion, tillgänglig från fumarylklorid och bensen i närvaro av aluminiumklorid .). Dibensoyletylen är övervägande närvarande i trans- konfigurationen men den kan omvandlas till den nödvändiga cis- konfigurationen genom enkel uppvärmning.
Den tidigare bildade 4,5-dibensoylcyklohexenen cykliseras med ättiksyraanhydrid till dihydroisobensofuranen. Genom bromtillsats och vätebromideliminering bildas 1,2-dibensoylbensen och recirkuleras med zinkatiksyra till slutprodukten 1,3-difenylisobensofuran. En publikation från 1940 beskriver höga utbyten för de individuella stegen i den omfattande reaktionssekvensen.
Den (mycket billigare) ftaloylkloriden ger också tillgång till 1,2-dibensoylbensen via Friedel-Crafts acylering med bensen, som reduceras till 1,3-difenylisobensofuran med 78 % utbyte med hjälp av kaliumborhydrid.
Syntesen av 1,3-diarylisobensofuraner från 2-acylbensaldehyder och boronsyror är mindre krånglig och ger bättre utbyte,
precis som syntesen från salicylaldehyder via fenacylhydrazoner, som genomgår oxidation med bly(IV)acetat för att ge orto -diketoner, följt av reaktionen med ett aryl Grignard-reagens .
Egenskaper
1,3-Diphenylisobenzofuran är ett gult, ljus- och luftkänsligt, kristallint fast ämne som är lösligt i många organiska lösningsmedel med en maximal absorption runt 420 nm (i lösning), vilket genererar intensiv fluorescens . Fluorescensmätningar kan utföras i DMF och DMSO på grund av stabiliteten hos 1,3-DPBF i dessa lösningsmedel. I kloroform och koltetraklorid fotolyseras den lösta 1,3-difenylisobensofuranen snabbt genom attack av CHCl2- och CCl3 - radikaler , även i frånvaro av syre. [24]
Med etanol bildar 1,3-difenylisobensofuran en orangegul, fluorescerande lösning. Vid bestrålning bildar den en färglös fotodimer (vid uteslutning av syre), vid missfärgning av lösningen.
Föreningens brytningsindex är 1 6700 vid 25 °C och 589 nm.
Använda sig av
Reagens för bestämning av singlettsyre
I närvaro av metylenblått bestrålat med rött laserljus reagerar 1,3-difenylisobensofuran med intermediär singletsyre 1 O 2 och bildar en instabil peroxid som sönderdelas till (färglös) 1,2-dibensoylbensen. Detekteringen av singlettsyre med 1,3-difenylisobensofuran är baserad på denna reaktion, även i biologiska system. För biologiska system utvecklades vattenlösliga derivat av 1,3-difenylisobensofuran. Singletsyregenereringen av fotosensibilisatorer övervakades genom fotolys av 1,3-difenylisobensofuran (DPBF). 1,2-Dibensoylbensen absorberas vid <300 nm, vilket gör DPBF till en optimal kemisk fälla för att detektera singlettsyre, eftersom de flesta fotosensibilisatorer absorberar <400-600 nm. Detta möjliggör en noggrann bestämning av fotonedbrytningen av molekylen.
Dienofil i Diels-Alders reaktioner
Isobensofuraner som 1,3-difenylisobensofuran är bland de mest reaktiva Diels-Alder-dienerna som är kända hittills och är användbara för att avlägsna kortlivade och instabila olefiner och alkyner. Gruppen ledd av Georg Wittig gav viktiga bidrag till detta ämne.
Med det instabila cyklohexynet reagerar 1,3-difenylisobensofuran till en tricyklisk förening som ger en 9,10-difenylcyklohexenonaftalen efter hydrering och väteabstraktion.
1,3-difenylisobensofuran ger på samma sätt med benzyn (dehydrobensen) en syrebryggad antracen (i 85 % utbyte), som kan reduceras med zink till 9,10-difenylantracen (88 % utbyte).
Cyklopropenon (som är instabilt över sin smältpunkt på -29 °C) reagerar kvantitativt vid rumstemperatur med 1,3-difenylisobensofuran för att bilda en Diels-Alder-addukt, som uteslutande är en exo- isomer .
Dimetylacetylendikarboxylat reagerar med 1,3-difenylisobensofuran som dienofil i 84 % utbyte för att ge motsvarande addukt.
1,3-difenylisobensofuran reagerar också med heterocykliska dienofiler såsom 3-sulfolen till motsvarande Diels-Alder-addukt.
Molekylär byggsten för polyaromatics
Polyaromatiska kolväten (PAH) är av intresse som prekursorer till grafit men väcker också oro som ingredienser i föroreningar. De har persistens och cancerframkallande egenskaper . 1,3-difenylisobensofuran reagerar kvantitativt med acenaftylen vid upphettning till 160 °C för att ge 7,12-difenylbenso[k]fluoranten.
Den två gånger förekommande Diels-Alder-reaktionen av 1,3-difenylisobensofuran med p- bensokinon ger nästan kvantitativt en produkt som kan reageras vidare med p-toluensulfonsyra för att ge ett pentacenderivat med 49 % utbyte.
Litteratur
- W. Friedrichsen (1980), "Benzo[c]furans", Adv. Heterocykl. Chem. Advances in Heterocyclic Chemistry, vol. 26, s. 135–234, doi : 10.1016/S0065-2725(08)60141-5 , ISBN 9780120206261
- W. Friedrichsen (1999), "Senaste framsteg inom kemi av benso[c]furaner och relaterade föreningar", Adv. Heterocykl. Chem. Advances in Heterocyclic Chemistry, vol. 73, s. 1–96, doi : 10.1016/S0065-2725(08)60940-X , ISBN 9780120207732
- R. Rodrigo (1988), "Progress in the chemistry of isobensofurans: Applications to the synthesis of naturliga produkter och polyaromatiska kolväten", Tetrahedron , vol. 44, nr. 8, s. 2093–2135, doi : 10.1016/S0040-4020(01)81720-8