Triättiksyra lakton

|
|
| Namn | |
|---|---|
|
Föredraget IUPAC-namn
4-hydroxi-6-metyl-2H- pyran -2-on |
|
Andra namn
|
|
| Identifierare | |
|
3D-modell ( JSmol )
|
|
| ChEBI | |
| ChemSpider | |
| ECHA InfoCard | 100.010.564 |
| EG-nummer |
|
|
PubChem CID
|
|
| UNII | |
|
CompTox Dashboard ( EPA )
|
|
|
|
|
|
| Egenskaper | |
| C6H6O3 _ _ _ _ _ | |
| Molar massa | 126,12 g mol -1 |
| Utseende | ljusgult kristallpulver |
| Densitet | 1,348 g cm −3 |
| Smältpunkt | 188 till 190 °C (370 till 374 °F; 461 till 463 K) |
| Kokpunkt | 285,9 °C (546,6 °F; 559,0 K) |
| 8,60 g L-1 vid 20°C i H2O | |
| Faror | |
| Arbetssäkerhet och hälsa (OHS/OSH): | |
|
Huvudsakliga faror
|
Måttligt giftig |
| GHS- märkning : | |

|
|
| Varning | |
| H315 , H319 , H335 | |
| P261 , P264 , P271 , P280 , P302+P352 , P304+P340 , P305+P351+P338 , P312 , P321 , P332 + P313 , P337 +P313 , P337 + P323 3P , P 30 , P 5 1 | |
| Flampunkt | 127,9 °C (262,2 °F; 401,0 K) |
|
Om inte annat anges ges data för material i standardtillstånd (vid 25 °C [77 °F], 100 kPa).
|
|
Triättiksyralakton (TAL; 4-hydroxi-6-metyl-2-pyron) är en organisk förening som erhålls enzymatiskt från glukos . Det är en ljusgul fast substans som är löslig i organiska lösningsmedel.
Strukturera
Triättiksyralakton består av två huvudtautomerer .
Tautomeren till vänster, med en 4-hydroxigrupp, C4-kolet, är dominant. Triättiksyralakton klassificeras som en 2-pyronförening på grund av ketongruppen på C2-kolet i dess dominerande form.
Syntes
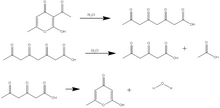
Triättiksyralakton syntetiseras antingen från dehydroättiksyra , ett annat 2-pyronderivat , eller från glukos genom enzymatisk katalys. I sin ursprungliga syntes erhölls triättiksyralakton genom behandling av dehydroättiksyra med svavelsyra vid 135 °C. Dehydroättiksyra genomgår ringöppning och hydratisering för att bilda "tetraättiksyra". Vid kylning återgår triättiksyran till en laktonring som liknar dehydroättiksyrastrukturen, och triättiksyralaktonen utvinns genom kristallisation i kallt vatten.
Biosyntes
Den mikrobiella syntesen av triättiksyralakton kräver enzymet 2-pyronsyntas (2-PS). Detta enzym har undersökts i två värdar Escherichia coli och Saccharomyces cerevisiae. Saccharomyces cerevisiae-värden som används under syntesen ger ett högre utbyte (70%) jämfört med Escherichia coli-värden, som ger ett utbyte av 40% triättiksyralakton. Detta enzym katalyserar syntesen av triättiksyralakton från acetyl-CoA via två efterföljande kondensationer med malonyl-CoA . Detta ger en mellanprodukt av 3,5-diketohexanoat-tioester, som genomgår ringslutning för att producera triättiksyralakton.
Reaktivitet
Laktonen är en mångsidig mellanprodukt i organisk syntes . Det har också beskrivits som en plattformskemikalie, vilket betyder att det kan vara föregångaren till andra finkemikalier. Laktonen genomgår dekarboxylering till acetylaceton . Det är också en föregångare till sorbinsyra , diensyra och hexensyra. Diensyra används för att hämma tillväxten av olika mögelsvampar och hexensyra används som smakämne. Acetylaceton används för metallextraktion och plätering och som livsmedelstillsats.
- ^ "Ny hållbar produktionsmetod kunde främja plaster och läkemedel" (Pressmeddelande). University of Texas. 13 februari 2018 – via Drug Discovery & Development Magazine.
- ^ Collie, J. Norman (1891). "LVI.? Laktonen av triättiksyra" . Journal of the Chemical Society, Transactions . 59 : 607-617. doi : 10.1039/CT8915900607 .
- ^ Xie, Dongming; Shao, Zengyi; Achkar, Jihane; Zha, Wenjuan; Frost, John W.; Zhao, Huimin (2006). "Mikrobiell syntes av triättiksyralakton". Bioteknik och bioteknik . 93 (4): 727–36. doi : 10.1002/bit.20759 . PMID 16245348 . S2CID 2626483 .
- ^ Moreno-Mañas, Marcial; Pleixats, Roser (1992). "Dehydroättiksyra, triättiksyralakton och relaterade pyroner". Framsteg inom heterocyklisk kemi . 53 : 1–84. doi : 10.1016/S0065-2725(08)60861-2 . ISBN 9780120207534 .
- ^ Jacoby, Mitch (2012). "Teaming Up for Biobased Chemicals". Chem. Eng. Nyheter . 90 (32): 37–38. doi : 10.1021/cen-09032-scitech1 .
- ^ Chia, Mei; Schwartz, Thomas J.; Shanks, Brent H.; Dumesic, James A. (2012). "Triättiksyralakton som en potentiell bioförnybar plattformskemikalie". Grön kemi . 14 (7): 1850. doi : 10.1039/C2GC35343A .