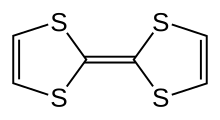
Tetrathiafulvalene
|
|

|
|

|
|
| Namn | |
|---|---|
|
Föredraget IUPAC-namn
2,2'-Bi(1,3-ditiolyliden) |
|
| Andra namn A2,2-Bi-1,3-ditiol
|
|
| Identifierare | |
|
3D-modell ( JSmol )
|
|
| 1282106 | |
| ChEBI | |
| ChemSpider | |
| ECHA InfoCard | 100.045.979 |
| EG-nummer |
|
|
PubChem CID
|
|
| UNII | |
|
CompTox Dashboard ( EPA )
|
|
|
|
|
|
| Egenskaper | |
| C6H4S4 _ _ _ _ _ | |
| Molar massa | 204,34 g·mol -1 |
| Utseende | Gult fast ämne |
| Smältpunkt | 116 till 119 °C (241 till 246 °F; 389 till 392 K) |
| Kokpunkt | Bryts ner |
| Olöslig | |
| Löslighet i organiska lösningsmedel | Löslig [ vag ] |
| Strukturera | |
| 0 D | |
| Faror | |
| Arbetsmiljö och hälsa (OHS/OSH): | |
|
Huvudsakliga faror
|
brännbar |
| GHS- märkning : | |

|
|
| Varning | |
| H317 | |
| P261 , P280 , P302+P352 , P333+P313 , P363 , P501 | |
| Besläktade föreningar | |
|
Besläktade föreningar
|
TCNQ , tiofen |
|
Om inte annat anges ges data för material i standardtillstånd (vid 25 °C [77 °F], 100 kPa).
|
|
Tetrathiafulvalene ( TTF ) är en organosvavelförening med formeln ( H 2 C 2 S 2 C) 2 . Studier av denna heterocykliska förening bidrog till utvecklingen av molekylär elektronik . TTF är relaterat till kolvätet fulvalen , (C 5 H 4 ) 2 , genom ersättning av fyra CH-grupper med svavelatomer. Över 10 000 vetenskapliga publikationer diskuterar TTF och dess derivat.
Förberedelse
Det höga intresset för TTF har lett till utvecklingen av många synteser av TTF och dess analoger. De flesta preparat medför kopplingen av cykliska oner . C3S2 - byggstenar såsom 1,3-ditiol -2-tion eller relaterade 1,3-ditiol-2- För själva TTF börjar syntesen med tritiokarbonatet H 2 C 2 S 2 CS , som S-metyleras och sedan reduceras för att ge H 2 C 2 S 2 CH(SCH 3 ) , som behandlas enligt följande:
Redoxegenskaper
Bulk TTF själv har omärkliga elektriska egenskaper. Särskiljande egenskaper är emellertid associerade med salter av dess oxiderade derivat, såsom salter härledda från TTF + .
Den höga elektriska konduktiviteten hos TTF-salter kan tillskrivas följande egenskaper hos TTF: (i) dess planaritet, som tillåter π-π-stapling av dess oxiderade derivat, (ii) dess höga symmetri, som främjar laddningsdelokalisering , och därigenom minimerar coulombiska repulsioner och (iii) dess förmåga att genomgå oxidation vid milda potentialer för att ge en stabil radikalkatjon . Elektrokemiska mätningar visar att TTF kan oxideras två gånger reversibelt:
Varje ditiolylidenring i TTF har 7π elektroner: 2 för varje svavelatom, 1 för varje sp 2 kolatom. Således omvandlar oxidation varje ring till en aromatisk 6π-elektronkonfiguration, vilket följaktligen lämnar den centrala dubbelbindningen väsentligen en enkelbindning, eftersom alla π-elektroner upptar ringorbitaler.
Historia
Saltet [TTF +
]Cl− rapporterades vara en halvledare 1972. Därefter
visades laddningsöverföringssaltet [TTF] TCNQ vara en halvledare med smalbandsgap . Röntgendiffraktionsstudier av [TTF][TCNQ] avslöjade staplar av delvis oxiderade TTF-molekyler intill anjoniska staplar av TCNQ-molekyler. Detta "segregerade stack"-motiv var oväntat och är ansvarigt för de distinkta elektriska egenskaperna, dvs hög och anisotrop elektrisk ledningsförmåga . Sedan dessa tidiga upptäckter har många analoger av TTF framställts. Väl studerade analoger inkluderar tetrametyltetratiafulvalen (Me 4 TTF), tetrametylselenafulvalener (TMTSF) och bis(etylenditio) tetratiafulvalen (BEDT-TTF, CAS [66946-48-3]). Flera tetrametyltetrathiafulvalensalter (kallade Fabre-salter ) är av viss relevans som organiska supraledare .
Se även
Vidare läsning
- Rovira, C. (2004). "Bis(etylentio)tetratiafulvalen (BET-TTF) och relaterade dissymmetriska elektrondonatorer: från molekylen till funktionella molekylära material och anordningar (OFETs)". Kemiska recensioner . 104 (11): 5289–5317. doi : 10.1021/cr030663+ . PMID 15535651 .
- Iyoda, M; Hasegawa, M; Miyake, Y (2004). "Bi-TTF, Bis-TTF och relaterade TTF-oligomerer". Kemiska recensioner . 104 (11): 5085–5113. doi : 10.1021/cr030651o . PMID 15535643 .
- Frere, P.; Skabara, PJ (2005). "Salter av förlängda Tetrathiafulvalene-analoger: relationer mellan molekylär struktur, elektrokemiska egenskaper och solid state-organisation". Chemical Society recensioner . 34 (1): 69–98. doi : 10.1039/b316392j . PMID 15643491 .
- Gorgues, Alain; Hudhomme, Pietrick; Salle, Marc. (2004). "Högt funktionaliserade Tetrathiafulvalenes: Ridning längs den syntetiska leden från elektrofila alkyner". Kemiska recensioner . 104 (11): 5151–5184. doi : 10.1021/cr0306485 . PMID 15535646 .
- Fysikaliska egenskaper hos Tetrathiafulvalene från litteraturen.
![{\displaystyle {\ce {H2C2S2CH(SCH3) + HBF4 -> [H2C2S2CH+]BF4- + HSCH3}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/00431ff870a019343fc6dc0f52a071cc115e50c0)
![{\displaystyle {\ce {2 [H2C2S2CH+]BF4- + 2 Et3N -> (H2C2S2C)2 + 2 Et3NHBF4}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/2c531245c41dd4fe308b5a448f1cc7a8d518fb4c)




