Kobalaminbiosyntes
Kobalaminbiosyntes är den process genom vilken bakterier och arkea gör kobalamin , vitamin B12 . Många steg är involverade i att omvandla aminolevulinsyra via uroporfyrinogen III och adenosylkobyrinsyra till de slutliga former i vilka den används av enzymer i både producerande organismer och andra arter, inklusive människor som förvärvar den genom sin diet.
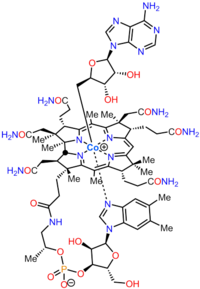
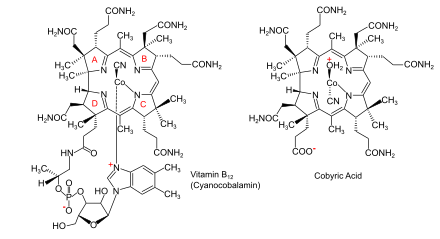
Det särdrag som skiljer de två huvudsakliga biosyntesvägarna är huruvida kobolten som finns på det katalytiska stället i koenzymet inkorporeras tidigt (i anaeroba organismer ) eller sent (i aeroba organismer ) och om syre krävs. I båda fallen makrocykeln som kommer att bilda ett koordinationskomplex med koboltjonen en korrinring , närmare bestämt en med sju karboxylatgrupper som kallas kobyrinsyra. Därefter bildas amidgrupper på alla utom ett av karboxylaterna, vilket ger kobyrinsyra, och kobolten ligeras av en adenosylgrupp . I den sista delen av biosyntesen, gemensam för alla organismer, läggs en aminopropanolsidokedja till den ena fria karboxylgruppen och sammansättningen av nukleotidslingan, som kommer att tillhandahålla den andra liganden för kobolten, är fullbordad.
Många prokaryota arter kan inte biosyntetisera adenosylkobalamin , men kan göra det från kobalamin som de assimilerar från externa källor. Hos människor binds kostkällor för kobalamin efter intag som transkobalaminer och omvandlas till de koenzymformer i vilka de används.
Kobalamin
Kobalamin (vitamin B 12 ) är det största och mest strukturellt komplexa vitaminet . Den består av en modifierad tetrapyrrol , en corrin, med en centralt kelaterad koboltjon och finns vanligtvis i en av två biologiskt aktiva former: metylkobalamin och adenosylkobalamin . De flesta prokaryoter , såväl som djur, har kobalaminberoende enzymer som använder det som en kofaktor , medan växter och svampar inte använder det. I bakterier och archaea inkluderar dessa enzymer metioninsyntas , ribonukleotidreduktas , glutamat och metylmalonyl - CoA-mutaser , etanolaminammoniaklyas och dioldehydratas . Hos vissa däggdjur erhålls kobalamin genom kosten och krävs för metioninsyntas och metylmalonyl-CoA-mutas . Hos människor spelar det väsentliga roller i folatmetabolismen och i syntesen av citronsyracykelns intermediär, succinyl-CoA .
Översikt över kobalaminbiosyntes
Det finns minst två distinkta biosyntesvägar för kobalamin i bakterier :
- Aerob väg som kräver syre och i vilken kobolt sätts in sent i vägen; finns i Pseudomonas denitrificans och Rhodobacter capsulatus .
- Anaerob väg i vilken koboltinsättning är det första engagerade steget mot kobalaminsyntes; finns i Salmonella typhimurium , Bacillus megaterium och Propionibacterium freudenreichii subsp. shermanii .
Båda vägarna kan delas in i två delar:
- Corrinringsyntes som leder till kobyrinsyra, med sju karboxylatgrupper . I den anaeroba vägen innehåller detta redan kobolt men i den aeroba vägen är materialet som bildas vid det stadiet hydrogenobyrinsyra, utan den bundna kobolten.
- Införande av kobolt, där det inte redan finns; bildning av amider på alla utom en av karboxylatgrupperna för att ge kobyrinsyra; bindning av en adenosylgrupp som ligand till kobolten; vidfästning av en aminopropanolsidokedja till den ena fria karboxylgruppen och sammansättning av nukleotidslingan som kommer att tillhandahålla den andra liganden för kobolten.
Ytterligare en typ av syntes sker genom en räddningsväg , där yttre korrinoider absorberas för att göra B12 . Arter från följande släkten och följande individuella arter är kända för att syntetisera kobalamin: Propionibacterium shermanii , Pseudomonas denitrificans , Streptomyces griseus , Acetobacterium , Aerobacter , Agrobacterium , Alcaligenes , Azotobacter , Bacillus bacterium , Corilluobacterium , Clostride bacterium , Flavobacterium , Micromonospora , Mycobacterium , Nocardia , Proteus , Rhizobium , Salmonella , Serratia , Streptococcus och Xanthomonas .
Detalj av steg fram till bildning av uroporfyrinogen III
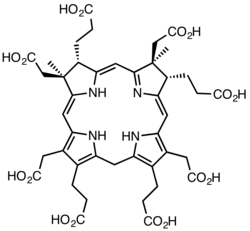
I de tidiga stegen av biosyntesen skapas ett tetrapyrroliskt strukturellt ramverk av enzymerna deaminas och cosyntetas som transformerar aminolevulinsyra via porfobilinogen och hydroximetylbilan till uroporfyrinogen III . Den senare är den första makrocykliska mellanprodukten som är vanlig för hem , klorofyll , sirohem och kobalamin själv.
Detalj av steg från uroporfyrinogen III till cob(II)yrinsyra a,c-diamid i aeroba organismer
Biosyntesen av kobalamin avviker från den för hem och klorofyll vid uroporphrinogen III: dess omvandling innebär sekventiell addition av metyl (CH 3 ) grupper för att ge intermediärer som fick trivialnamn enligt antalet av dessa grupper som har inkorporerats. Följaktligen är den första mellanprodukten precorrin-1, nästa är precorrin-2 och så vidare. Inkorporeringen av alla åtta ytterligare metylgrupper som förekommer i kobyrinsyra undersöktes med användning av 13C -metylmärkt S-adenosylmetionin . Det var inte förrän forskare vid Rhône-Poulenc Rorer använde en genetiskt modifierad stam av Pseudomonas denitrificans , där åtta av cob -gener som var involverade i biosyntesen av vitaminet hade överuttryckts , som den fullständiga sekvensen av metylering och andra steg kunde fastställas , vilket helt och hållet etablerar alla mellanprodukter i vägen.
Från uroporfyrinogen III till prekorrin-2
Enzymet CobA katalyserar två metyleringar för att ge prekorrin-2 :
- (1a) uroporfyrinogen III + S-adenosylmetionin prekorrin-1 + S-adenosyl-L-homocystein
- (1b) prekorrin-1 + S-adenosylmetionin precorrin-1 S-adenosyl-L-homocystein
Från precorrin-2 till precorrin-3A
Enzymet CobI omvandlar sedan detta till precorrin-3A:
- prekorrin-2 + S-adenosylmetionin prekorrin-3A + S-adenosyl-L-homocystein
Från precorrin-3A till precorrin-3B
Därefter transformerar enzymet CobG precorrin-3A till precorrin-3B:
- precorrin-3A + NADH + H + + O 2 precorrin-3B + NAD + + H 2 O
Detta enzym är ett oxidoreduktas som kräver syre och därför kan reaktionen endast fungera under aeroba förhållanden. Namnet på dessa prekorriner som 3A och 3B återspeglar det faktum att var och en innehåller tre fler metylgrupper än uroporfyrinogen III men med olika strukturer: i synnerhet har prekorrin-3B en inre y-laktonring bildad av ring A ättiksyrasidokedjan som sluter sig tillbaka vidare till makrocykeln.
Från precorrin-3B till precorrin-4
Enzymet CobJ fortsätter på temat metylgruppsinsättning. Viktigt är att under detta steg drar makrocykeln ihop sig så att produkten för första gången innehåller korrinkärnan som kännetecknar kobalamin.
- prekorrin-3B + S-adenosylmetionin prekorrin-4 + S-adenosyl-L-homocystein
Från precorrin-4 till precorrin-5
Metylgruppsinsättningar fortsätter eftersom enzymet CobM verkar på prekorrin-4:
- prekorrin-4 + S-adenosylmetionin prekorrin-5 + S-adenosyl-L-homocystein
Den nyligen införda metylgruppen läggs till ring C vid kolet som är fäst vid metylen (CH 2 )-bryggan till ring B. Detta är inte dess slutliga placering på kobalamin eftersom ett senare steg involverar dess omlagring till ett intilliggande ringkol.
Från precorrin-5 till precorrin-6A
Enzymet CobF tar nu bort acetylgruppen i position 1 i ringsystemet i precorrin-4 och ersätter den med en nyintroducerad metylgrupp. Produktens namn, precorrin-6A, återspeglar det faktum att sex metylgrupper totalt har tillsatts till uroporfyrinogen III fram till denna punkt. Men eftersom en av dessa har extruderats med acetatgruppen, innehåller strukturen av precorrin-6A bara de återstående fem.
- prekorrin-5 + S-adenosylmetionin + H 2 O prekorrin-6A + S-adenosyl-L-homocystein + acetat
Från precorrin-6A till precorrin-6B
Enzymet CobK reducerar nu en dubbelbindning i ring D med hjälp av NADPH :
- precorrin-6A + NADPH + H + precorrin-6B + NADP +
Precorrin-6B skiljer sig därför i struktur från precorrin-6A endast genom att ha ytterligare två väteatomer.
Från precorrin-6B till precorrin-8
Enzymet CobL har två aktiva ställen, en som katalyserar två metylgruppstillsatser och den andra dekarboxyleringen av CH 2 COOH-gruppen på ring D, så att denna substituent blir en enkel metylgrupp:
- precorrin-6B + 2 S-adenosylmetionin precorrin-8X + 2 S-adenosyl-L-homocystein + CO 2
Från prekorrin-8 till hydrogenobyrinsyra
Enzymet CobH katalyserar en omlagringsreaktion, med resultatet att metylgruppen som hade lagts till ring C isomeriseras till sin slutliga plats, ett exempel på intramolekylär överföring :
- precorrin-8X hydrogenobyrinat
Från hydrogenobyrinsyra till hydrogenobyrinsyra a,c-diamid
Nästa enzym i vägen, CobB , omvandlar selektivt två av de åtta karboxylsyragrupperna till deras primära amider. ATP används för att tillhandahålla energin för amidbindningsbildning, med den överförda ammoniaken som kommer från glutamin :
- hydrogenobyrinsyra + 2 ATP + 2 glutamin + 2 H 2 O hydrogenobyrinsyra a,c-diamid + 2 ADP + 2 fosfat + 2 glutaminsyra
Från hydrogenobyrinsyra a,c-diamid till cob(II)yrinsyra a,c-diamid
Kobolt(II) -insättning i makrocykeln katalyseras av enzymet koboltkelatas (CobNST):
- hydrogenobyrinsyra a,c-diamid + Co 2+ + ATP + H 2 O cob(II)yrinsyra a,c-diamid + ADP + fosfat + H +
Det är i detta skede som den aeroba vägen och den anaeroba vägen smälter samman, och senare steg är kemiskt identiska.
Detalj av steg från uroporfyrinogen III till cob(II)yrinsyra a,c-diamid i anaeroba organismer
Många av stegen bortom uroporfyrinogen III i anaeroba organismer såsom Bacillus megaterium involverar kemiskt liknande men genetiskt distinkta transformationer som de i den aeroba vägen.
Från prekorrin-2 till kobolt-sirohydroklorin
Den viktigaste skillnaden i vägarna är att kobolt sätts in tidigt i anaeroba organismer genom att först oxidera prekorrin-2 till dess fullt aromatiserade form sirohydroklorin och sedan till den föreningens kobolt(II)-komplex . Dessa reaktioner katalyseras av CysG och sirohydroklorinkobaltochelatas .
Från kobolt-sirohydroklorin till kobolt-faktor III
Liksom i den aeroba vägen introduceras den tredje metylgruppen av ett metyltransferasenzym, CbiL :
- kobolt-sirohydroklorin + S-adenosylmetionin kobolt-faktor III + S-adenosyl-L-homocystein
Från kobolt-faktor III till kobolt-prekorrin-4
Metylering och ringkontraktion för att bilda korrinmakrocykeln sker därefter, katalyserad av enzymet kobolt-faktor III-metyltransferas (CbiH, EC 2.1.1.272 )
- kobolt-faktor III + S-adenosylmetionin kobolt-prekorrin-4 + S-adenosyl-L-homocystein
I denna väg innehåller det resulterande materialet en 5-lakton, en sexledad ring, snarare än y-laktonen (femledad ring) av prekorrin-3B.
Från kobolt-prekorrin-4 till kobolt-prekorrin-5A
Införandet av metylgruppen vid C-11 i nästa steg katalyseras av kobolt-prekorrin-4-metyltransferas (CbiF, EC 2.1.1.271 )
- kobolt-prekorrin-4 + S-adenosylmetionin kobolt-prekorrin-5 + S-adenosyl-L-homocystein
Från kobolt-prekorrin-5A till kobolt-prekorrin-5B
Scenen är nu inställd för extrudering av tvåkolsfragmentet motsvarande det acetat som frigörs vid bildningen av prekorrin-6A i den aeroba vägen. I det här fallet är det frigjorda fragmentet acetaldehyd och detta katalyseras av CbiG :
- kobolt-prekorrin-5A + H 2 O kobolt-prekorrin-5B + acetaldehyd + 2 H +
Från kobolt-prekorrin-5B till kobolt(II)yrinsyra a,c-diamid
Stegen från kobolt-prekorrin-5B till cob(II)yrinsyra a,c-diamid i den anaeroba vägen är väsentligen kemiskt identiska med de i den aeroba sekvensen. Mellanprodukterna kallas kobolt-prekorrin-6A, kobolt-prekorrin-6B, kobolt-prekorrin-8 och kobyrinsyra. Enzymerna i sekvens är CbiD ; kobolt-prekorrin-6A-reduktas (CbiJ, EC 1.3.1.106 ); CbiT , kobolt-prekorrin-8-metylmutas (CbiC, EC 5.4.99.60 ) och CbiA . Det slutliga enzymet bildar cob(II)yrinsyra a,c-diamid när de två vägarna konvergerar.
Detalj av steg från cob(II)yrinsyra a,c-diamid till adenosylkobalamin
Aeroba och anaeroba organismer delar samma kemiska väg bortom cob(II)yrinsyra a,c-diamid och detta illustreras för cob- genprodukterna.
Från cob(II)yrinsyra a,c-diamid till adenosylkobyrinsyra
Kobolt(II) reduceras till kobolt(I) av enzymet CobR och sedan binder enzymet CobO en adenosylligand till metallen. Därefter omvandlar enzymet CobQ alla karboxylsyror, förutom propionsyran på ring D, till deras primära amider.
Från adenosylkobyrinsyra till adenosylkobinamidfosfat
binder enzymet CobCD nu (R)-1-amino-2-propanol (härledd från treonin ) till propionsyran, bildar adenosylkobinamid och enzymet CobU fosforylerar den terminala hydroxigruppen för att bilda adenosylkobinamidfosfat. Samma slutprodukt bildas i anaeroba organismer genom direkt reaktion av adenosylkobyrinsyra med (R)-1-amino-2-propanol O-2-fosfat (härledd från treonin-O-fosfat av enzymet CobD) katalyserad av enzymet CbiB .
Från adenosylkobinamidfosfat till adenosylkobalamin
I en separat gren av vägen biosyntetiseras 5,6-dimetylbensimidazol från flavinmononukleotid av enzymet 5,6-dimetylbensimidazolsyntas och omvandlas av CobT till alfa-ribazol 5'-fosfat. Sedan aktiverar enzymet CobU adenosylkobinamidfosfat genom bildning av adenosylkobinamid-GDP och CobV länkar samman de två substraten för att bilda Adenosylkobalamin-5'-fosfat. I det sista steget till koenzymet CobC bort 5'-fosfatgruppen:
- Adenosylkobalamin-5'-fosfat + H 2 O adenosylkobalamin + fosfat
Den fullständiga biosyntesvägen innefattar en lång linjär väg som kräver cirka 25 bidragande enzymsteg.
Andra vägar för kobalaminmetabolism
Räddningsvägar hos prokaryoter
Många prokaryota arter kan inte biosyntetisera adenosylkobalamin, men kan göra det från kobalamin. Dessa organismer kan transportera kobalamin in i cellen och dess omvandling till den nödvändiga koenzymformen. Även organismer som Salmonella typhimurium som kan göra kobalamin assimilerar det också från externa källor när det är tillgängligt. Upptag i celler underlättas av ABC-transportörer som absorberar kobalamin genom cellmembranet.
Kobalaminmetabolism hos människor
Hos människor binds kostkällor för kobalamin efter intag som transkobalaminer . De omvandlas sedan till de koenzymformer som de används i. Methylmalonic aciduria och homocystinuria typ C-protein är enzymet som katalyserar decyaneringen av cyanokobalamin såväl som dealkyleringen av alkylkobalaminer inklusive metylkobalamin och adenosylkobalamin.
Vidare läsning
- Layer, Gunhild; Jahn, Dieter; Deery, Evelyne; Lawrence, Andrew D.; Warren, Martin J. (2010). "Biosyntes av heme och vitamin B12". Heltäckande naturprodukter II . s. 445–499. doi : 10.1016/B978-008045382-8.00144-1 . ISBN 9780080453828 .
externa länkar
- Prof Sir Alan Battersby: biosyntesen av vitamin B 12 St. Catharine's College, Cambridge, video