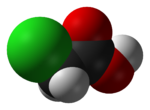
Klorättiksyra

|
|
|
|
| Namn | |
|---|---|
|
Föredraget IUPAC-namn
Klorättiksyra |
|
|
Systematiskt IUPAC-namn
Kloretansyra |
|
| Andra namn 2-kloroättiksyra 2-kloretansyra |
|
| Identifierare | |
|
3D-modell ( JSmol )
|
|
| 3DMet | |
| ChEBI | |
| ChEMBL | |
| ChemSpider | |
| ECHA InfoCard | 100.001.072 |
| EG-nummer |
|
| KEGG | |
|
PubChem CID
|
|
| RTECS-nummer |
|
| UNII | |
|
CompTox Dashboard ( EPA )
|
|
|
|
|
|
| Egenskaper | |
| C2H3ClO2 _ _ _ _ _ _ | |
| Molar massa | 94,49 g·mol -1 |
| Utseende | Färglösa eller vita kristaller |
| Densitet | 1,58 g/cm 3 |
| Smältpunkt | 63 °C (145 °F; 336 K) |
| Kokpunkt | 189,3 °C (372,7 °F; 462,4 K) |
| 85,8 g/100 ml (25 °C) | |
| Löslighet | Löslig i metanol , aceton , dietyleter , bensen , kloroform , etanol |
| log P | 0,22 |
| Ångtryck | 0,22 hPa |
| Surhet (p K a ) | 2,86 |
| -48,1 × 10 -6 cm 3 /mol | |
|
Brytningsindex ( n D )
|
1,4351 (55 °C) |
| Strukturera | |
| Monoklinisk | |
| Termokemi | |
|
Värmekapacitet ( C )
|
144,02 J/(K·mol) |
|
Std formationsentalpi ( Δ f H ⦵ 298 ) |
−490,1 kJ/mol |
| Faror | |
| Arbetssäkerhet och hälsa (OHS/OSH): | |
|
Huvudsakliga faror
|
alkyleringsmedel |
| GHS- märkning : | |
  
|
|
| Fara | |
| H301 , H311 , H314 , H331 , H400 | |
| P260 , P261 , P264 , P270 , P271 , P273 , P280 , P301+P310 , P301+P330+P331 , P302+P352 , P303 +P361+P043+ P3 P3+P3+P3+P3+P3 + P3 + , P310 , P311 , P312 , P321 , P322 , P330 , P361 , P363 , P391 , P403+P233 , P405 , P501 | |
| NFPA 704 (branddiamant) | |
| Flampunkt | 126 °C (259 °F; 399 K) |
| 470 °C (878 °F; 743 K) | |
| Dödlig dos eller koncentration (LD, LC): | |
|
LD 50 ( mediandos )
|
76 mg/kg. |
| Säkerhetsdatablad (SDS) | Externt MSDS |
| Besläktade föreningar | |
|
Besläktade föreningar
|
2-klorpropionsyra Natriumkloracetat |
|
Om inte annat anges ges data för material i standardtillstånd (vid 25 °C [77 °F], 100 kPa).
|
|
Kloroättiksyra , industriellt känd som monoklorättiksyra ( MCA ), är den organiska klorföreningen med formeln ClCH 2 CO 2 H. Denna karboxylsyra är en användbar byggsten i organisk syntes . Det är ett färglöst fast ämne. Besläktade föreningar är diklorättiksyra och triklorättiksyra .
Produktion
Kloroättiksyra framställdes först (i oren form) av den franske kemisten Félix LeBlanc (1813–1886) 1843 genom att klorera ättiksyra i närvaro av solljus och 1857 (i ren form) av den tyske kemisten Reinhold Hoffmann (1831– 1919) genom att återloppskoka isättika i närvaro av klor och solljus, och sedan av den franske kemisten Charles Adolphe Wurtz genom hydrolys av kloracetylklorid (ClCH 2 COCl), också 1857.
Kloroättiksyra framställs industriellt på två sätt. Den dominerande metoden involverar klorering av ättiksyra , med ättiksyraanhydrid som katalysator :
-
COOH H3C - Cl2
COOH + → ClH2C
- _ + HCl
Denna väg lider av produktionen av diklorättiksyra och triklorättiksyra som föroreningar, vilka är svåra att separera genom destillation :
-
H
3 C−COOH + 2 Cl
2 → Cl
2 HC−COOH + 2 HCl -
H
3 C−COOH + 3 Cl
2 → Cl
3 C−COOH + 3 HCl
Den andra metoden innebär hydrolys av trikloretylen :
-
H2O → ClHC =CCl2 + 2 ClH2C −
COOH + 2 HCl
Hydrolysen utförs vid 130–140 °C i en koncentrerad (minst 75 %) lösning av svavelsyra. Denna metod ger en mycket ren produkt, till skillnad från halogeneringsvägen. De betydande mängderna HCl som frigörs har dock lett till den ökade populariteten för halogeneringsvägen. Cirka 420 000 ton produceras globalt per år.
Användningar och reaktioner
De flesta reaktioner drar fördel av den höga reaktiviteten hos C-Cl-bindningen.
I sin största applikation används klorättiksyra för att framställa förtjockningsmedlet karboximetylcellulosa och karboximetylstärkelse .
Kloroättiksyra används också vid framställning av fenoxiherbicider genom företring med klorfenoler. På detta sätt framställs 2-metyl-4-klorfenoxiättiksyra (MCPA), 2,4-diklorfenoxiättiksyra och 2,4,5-triklorfenoxiättiksyra (2,4,5-T). Det är föregångaren till herbiciden glyfosat och dimetoat . Kloroättiksyra omvandlas till kloracetylklorid , en föregångare till adrenalin (epinefrin). Ersättning av klorid med sulfid ger tioglykolsyra , som används som stabilisator i PVC och en komponent i vissa kosmetika .
Illustrativt för dess användbarhet i organisk kemi är O -alkylering av salicylaldehyd med klorättiksyra, följt av dekarboxylering av den resulterande etern , vilket ger bensofuran .
Säkerhet
Liksom andra klorättiksyror och relaterade halogenkolväten är klorättiksyra ett farligt alkyleringsmedel . LD . 50 för råttor är 76 mg/kg
Det är klassificerat som ett extremt farligt ämne i USA enligt definitionen i avsnitt 302 i US Emergency Planning and Community Right-to-Know Act (42 USC 11002), och är föremål för strikta rapporteringskrav från anläggningar som producerar, lagrar, eller använda den i betydande mängder.
Se även
externa länkar
- "Monoklorättiksyra" . CABB. Arkiverad från originalet den 6 februari 2015 . Hämtad 6 februari 2015 .
- "Monoklorättiksyra" . IPCS Inchem . Hämtad 20 maj 2007 .