EnvZ/OmpR tvåkomponentsystem
EnvZ/OmpR är ett tvåkomponents regulatoriskt system som är brett distribuerat i bakterier och särskilt väl karaktäriserat i Escherichia coli . Dess funktion är osmoreglering , som svarar på förändringar i miljöosmolalitet genom att reglera uttrycket av de yttre membranporinerna OmpF och OmpC. EnvZ är ett histidinkinas som också har en cytoplasmatisk osmosensorisk domän, och OmpR är dess motsvarande svarsregulatorprotein.
Översikt
EnvZ är en sensor-sändare som sträcker sig över det inre cytoplasmatiska membranet och har historiskt sett delats upp i två domäner , den sensoriska och transmittordomänen. Proteinet består av en kort N-terminal svans i periplasman , två transmembranregioner med en mellanliggande periplasmatisk slinga och en cytoplasmatisk domän som innehåller den autofosforylerade histidinresten , som är belägen i ett dimeriskt fyrhelixknippe . Variationer i osmolalitet utlöser konformationsförändringar i EnvZ som har lokaliserats till den cytoplasmatiska fyrhelixbunten och som påverkar fosforylöverföring till OmpR. Vid fosforylering blir OmpR en aktiv dimer som uppvisar förbättrad DNA-bindningsförmåga specifik för både ompC- och ompF -generna. Signaleringskaskaden kan belysas enligt följande:
- Aktivering av den inre membransensorn histidinkinas EnvZ,
- Autofosforylering av EnvZ vid His243 ,
- Fosfatöverföring till OmpR vid Asp 55 ,
- Bindning av OmpR-P till uppströmsställen på ompF- och ompC- porinpromotorerna för att differentiellt modulera deras transkription .
- Defosforylering av OmpR-P via fosfatasfunktionen hos EnvZ.
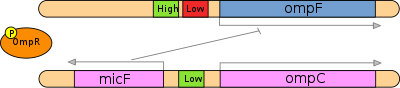
Det är viktigt att notera att ompF och ompC uttrycks hela tiden vid konstanta nivåer; emellertid finns de individuella porinerna OmpF och OmpC i olika relativa mängder baserat på medium osmolaritet. Mängden OmpF och OmpC kontrolleras också av en mängd olika mekanismer; till exempel undertrycks syntes av OmpF också av hög temperatur. På samma sätt EnvZ-OmpR- paret involverat i tripeptidpermeassystem som är helt fritt från osmotisk kontroll. Kontrollen av EnvZ-OmpR över OmpF och OmpC är dock en betydande mekanism. [ citat behövs ]
Lågt osmolaritetssvar
När medium osmolaritet är låg , uppvisar EnvZ jämförelsevis låg kinasaktivitet (dvs hög fosfatasaktivitet) mot OmpR. Följaktligen är mängden av den fosforylerade formen av OmpR i celler relativt liten. I denna speciella situation binder OmpR-P-komplexet kooperativt till F1- , F2- och F3 -aktivatorställena för ompF- genen och uppreglerar dess transkription . Dessa ställen har hög relativ affinitet för OmpR-P-komplex jämfört med Cl- , C2- och C3 -aktivatorställena för ompC . Därför är transkriptionsnivåer av ompC lägre jämfört med ompF under låg osmolaritetsförhållanden. Detta fenomen har tillskrivits det faktum att OmpF har en större pordiameter (1,12 nm) än OmpC (1,08 nm) vilket resulterar i en 10 gånger snabbare diffusionshastighet som ger en selektiv fördel vid låg osmolaritet för att snabbt fånga upp knappa näringsämnen . [ citat behövs ]
Hög osmolaritetsrespons
I händelse av hög medium osmolaritet genomgår EnvZ aktivt autofosforylering och överför sedan effektivt sina fosforylgrupper till den N-terminala mottagardomänen av OmpR genom EnvZ-OmpR-komplexbildning. När antalet fosforylerade OmpR-proteinmolekyler ökar inträffar två händelser: OmpR binder inte bara till högaffinitetsbindningsställena uppströms ompF - promotom utan även till det ena lågaffinitetsbindande stället. Bindning till detta lågaffinitetsställe resulterar i repression av ompF -genen. Vidare binder OmpR till de tre lågaffinitetsaktivatorställena uppströms om OmpC-promotorerna som ett resultat av ompC- genuttrycket stimuleras och mer OmpC-porinprotein uttrycks på cellens yttre membran. Dessutom initieras transkription av micF- antisens-mRNA vid hög medium osmolaritet. micF binder till komplementär sekvens av ompF- mRNA för att blockera dess translation. Dessa två mekanismer säkerställer att det är relativt högre uttryck av OmpC jämfört med OmpF under förhållanden med hög medium osmolaritet. [ citat behövs ]