Difenylketen

|
|

|
|
| Namn | |
|---|---|
|
Föredraget IUPAC-namn
2,2-difenyleten-1-on |
|
| Andra namn Difenyletenon
|
|
| Identifierare | |
|
3D-modell ( JSmol )
|
|
| ChemSpider | |
|
PubChem CID
|
|
| UNII | |
|
CompTox Dashboard ( EPA )
|
|
|
|
|
|
| Egenskaper | |
| C14H10O _ _ _ _ | |
| Molar massa | 194,233 g-mol -1 |
| Utseende | Röd-orange olja |
| Smältpunkt | 8 till 9 °C (46 till 48 °F; 281 till 282 K) |
| Kokpunkt | 118 till 120 vid 1 mmHg |
|
Om inte annat anges ges data för material i standardtillstånd (vid 25 °C [77 °F], 100 kPa).
|
|
Difenylketen är ett kemiskt ämne i ketenfamiljen . Difenylketen, som de flesta disubstituerade ketener , är en röd-orange olja vid rumstemperatur och tryck . På grund av de successiva dubbelbindningarna i ketenstrukturen R1R2C = C=O är difenylketen en heterokumul . Den viktigaste reaktionen för difenylketen är [2+2] -cykloadditionen vid CC-, CN-, CO- och CS-multipelbindningar.
Historia
Difenylketen isolerades först av Hermann Staudinger 1905 och identifierades som det första exemplet på den exceptionellt reaktiva klassen av ketener med den allmänna formeln R1R2C = C = O (R1 = R2 = fenylgrupp) .
Förberedelse
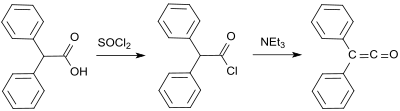
Den första syntesen av H. Staudinger baserades på 2-klordifenylacetylklorid (framställd av bensilsyra och tionylklorid ) från vilken två kloratomer klyvs med zink i en dehalogeneringsreaktion :
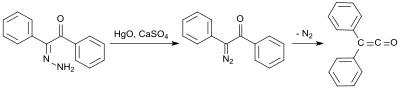
En tidig syntes använder bensilmonohydrazon (från difenyletandion och hydrazinhydrat ), som oxideras med kvicksilver(II)oxid och kalciumsulfat för att bilda mono-diazoketon, och sedan omvandlas till difenylketen vid 100 °C under kväveeliminering i 58 %:
En ytterligare tidig difenylketensyntes härstammar från Eduard Wedekind, som redan 1901 hade erhållit difenylketen genom dehydrohalogenering av difenylacetylklorid med trietylamin , dock utan isolering och karakterisering. Även denna variant beskrevs 1911 av H. Staudinger.
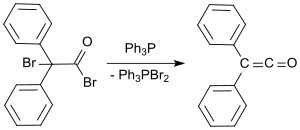
Ett standardlaboratorieprotokoll är baserat på Staudinger-metoden och ger difenylketen som en apelsinolja i utbyte på 53 till 57 %. I en nyare process bringas 2-brom-2,2-difenylacetylbromid att reagera med trifenylfosfin för att ge difenylketen i utbyten upp till 81 %.
Nyligen har en syntes av difenylketen från difenylättiksyra och Hendrickson-reagenset (trifenylfosfoniumanhydrid-trifluormetansulfonat) med vatteneliminering i 72 % utbyte rapporterats.
Egenskaper
Difenylketen är vid rumstemperatur en orangefärgad till röd olja (med färgen av koncentrerad kaliumdikromatlösning ) som är blandbar med opolära organiska lösningsmedel (som dietyleter , aceton , bensen , tetrahydrofuran , kloroform ) och stelnar i kallformning gula kristaller. Föreningen oxideras lätt med luft men kan förvaras i tätt slutna behållare vid 0 °C i flera veckor utan sönderdelning eller i kväveatmosfär med tillsats av en liten mängd hydrokinon som polymerisationshämmare.
Reaktivitet
Difenylketen kan genomgå attack från en mängd nukleofiler , inklusive alkoholer , aminer och enolater med ganska låga hastigheter. Dessa hastigheter kan ökas i närvaro av katalysatorer . För närvarande attackmekanismen okänd, men arbete pågår för att fastställa den exakta mekanismen.
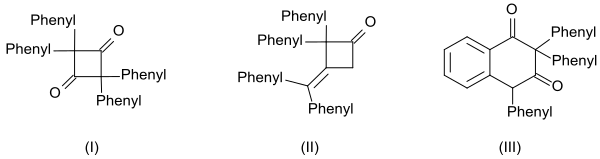
Den höga reaktiviteten hos difenylketenen är också uppenbar i bildandet av tre dimerer:
- den cykliska diketonen 2,2,4,4-tetrafenylcyklobutan-1,3-dion (I) genom upphettning med kinolin
- β-laktonen 4-(difenylmetylen)-3,3-difenyloxetan-2-on (II) genom upphettning med natriummetoxid och
- tetralinderivatet 2,2,4-trifenylnaftalen-1,3-(2H , 4H ) -dion (III) genom upphettning med bensoylklorid
och oligomerer framställda därav.
Ansökan
Ketener (med den allmänna formeln R 1 R 2 C=C=O) har många paralleller till isocyanater (med den allmänna formeln RN=C=O) i sin konstitution såväl som i sin reaktivitet.
Difenylketen reagerar med vatten i en additionsreaktion för att bilda difenylättiksyra, med etanol till difenylättiksyraetylester eller med ammoniak till motsvarande amid. Karboxylsyror producerar blandade anhydrider av difenylättiksyra, som kan användas för att aktivera skyddade aminosyror för peptidbindning .
Den skyddade dipeptiden Z-Leu-Phe-OEt (N-bensyloxikarbonyl-L-leucyl-L-fenylalaninetylester) erhålls sålunda i 59 % utbyte via aktivering av Z-leucin med difenylketen och efterföljande reaktion med fenylalaninetylester.
Difenylketen är benäget att autooxideras , där motsvarande polyester bildas vid temperaturer över 60 °C via en mellanliggande difenylacetolakton.
I en Wittig-reaktion kan allener framställas från difenylketen .
Med trifenylfosfin bildas difenylmetylen och difenylketen, vid t.ex. 140 °C och under tryck, tetrafenylallener i 70 % utbyte.
De syntetiskt mest intressanta reaktionerna av difenylketen är [2+2]cykloadditioner, t.ex. reaktionen med cyklopentadien som ger en Diels-Alder-addukt.
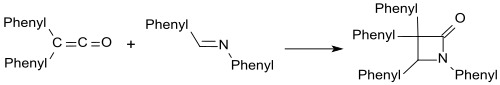
Iminer såsom bensalanilin bildar β-laktamer med difenylketen.
Med karbonylföreningar bildas β-laktoner analogt.
[2+2]cykloadditionen av difenylketen med fenylacetylen leder först till en cyklobutenon som termiskt aromatiserar till en fenylvinylketen och cykliserar i en [4+2]cykloaddition till 3,4-difenyl-1-naftol i 81 % utbyte.
Från denna så kallade Smith-Hoehn-reaktion har en allmän syntesmetod för substituerade fenoler och kinoner utvecklats.


2CO-O-CO-{}}}{\text{Z-Leu }}{\ce {->[{} \atop {\ce {H-Phe-OEt}}]}}{\text{ Z-Leu}}{\ce {-Phe-OEt}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/a7b4b915bc917b7c77143009ead9cc799bd83acc)