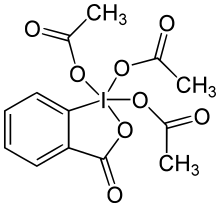
Dess–Martin periodinane
|
|

|
|
| Namn | |
|---|---|
|
Föredraget IUPAC-namn
3-Oxo-lλ5,2 - bensiodoxol-1,1,1(3H ) -triyltriacetat |
|
| Andra namn Dess–Martin periodinane
|
|
| Identifierare | |
|
3D-modell ( JSmol )
|
|
| ChemSpider | |
| ECHA InfoCard | 100.197.885 |
|
PubChem CID
|
|
| UNII | |
|
CompTox Dashboard ( EPA )
|
|
|
|
|
|
| Egenskaper | |
| C13H13IO 8 _ _ _ _ | |
| Molar massa | 424,14 g/mol |
| Utseende |
vitt pulver, chips, kristaller eller kristallint pulver och/eller bitar |
| Densitet | 1,362 g/cm ^ fast |
| Smältpunkt | 103 till 133 °C (217 till 271 °F; 376 till 406 K) |
| Besläktade föreningar | |
|
Besläktade föreningar
|
2-jodoxibensoesyra |
|
Om inte annat anges ges data för material i standardtillstånd (vid 25 °C [77 °F], 100 kPa).
|
|
Dess-Martin periodinane ( DMP ) är ett kemiskt reagens som används i Dess-Martin-oxidationen , som oxiderar primära alkoholer till aldehyder och sekundära alkoholer till ketoner . Denna periodinan har flera fördelar jämfört med krom- och DMSO -baserade oxidanter som inkluderar mildare förhållanden (rumstemperatur, neutralt pH), kortare reaktionstider, högre utbyten, förenklad upparbetning, hög kemoselektivitet, tolerans för känsliga funktionella grupper och en lång hållbarhetstid. Användning i industriell skala försvåras emellertid av dess kostnad och dess potentiellt explosiva natur. Det är uppkallat efter de amerikanska kemisterna Daniel Benjamin Dess och James Cullen Martin som utvecklade reagenset 1983. Det är baserat på IBX , men på grund av acetatgrupperna fästa till den centrala jodatomen är DMP mycket mer reaktivt än IBX och är mycket mer löslig i organiska lösningsmedel.
Förberedelse
Den mest vänliga syntesen av IBX har bestämts vara att behandla 2-jodbensoesyra med oxon i vatten, vid förhöjda temperaturer i 3 timmar. IBX acyleras sedan med hjälp av Irlands och Lius modifieringar från den ursprungliga proceduren. Dessa modifieringar möjliggjorde högre avkastning och ett förenklat upparbetningsförfarande. Det resulterande fasta ämnet kan erhållas via filtrering och tvättning med eter. Irland och Liu använde en katalytisk mängd tosylsyra , vilket gjorde att reaktionen kunde slutföras på mindre än 2 timmar (jämfört med den klassiska syntesen, med användning av 24 timmar) och i utbyten som översteg 90 %.
Den klassiska metoden som presenterades av RK Boeckman och JJ Mullins involverade uppvärmning av en lösning av kaliumbromat , svavelsyra , 2-jodbensoesyra för att ge IBX (1-hydroxi-1,2-bensiodoxol-3(1H)-on-1-oxid, 2 -jodoxibensoesyra ). IBX acylerades sedan med ättiksyra och ättiksyraanhydrid .
Oxidationsmekanism
Dess-Martin periodinane används främst som oxidationsmedel för komplexa, känsliga och multifunktionella alkoholer . En av anledningarna till dess effektivitet är dess höga selektivitet mot komplexbildning av hydroxylgruppen , vilket gör att alkoholer snabbt kan utföra ligandutbyte ; det första steget i oxidationsreaktionen.
Proton-NMR har indikerat att användning av en ekvivalent alkohol bildar intermediären diacetoxialkoxiperiodinan. Acetatet fungerar sedan som en bas för att deprotonera α-H från alkoholen för att ge karbonylföreningen, jodinan och ättiksyra .
När en diol eller mer än en ekvivalent alkohol används, bildas istället acetoxidialkoxiperiodinan. På grund av den labila naturen hos denna speciella periodinan sker oxidation mycket snabbare.
Schreiber och medarbetare har visat att vatten ökar hastigheten på oxidationsreaktionen. Dess och Martin hade ursprungligen observerat att oxidationen av etanol ökade när det fanns en extra ekvivalent etanol. Man tror att dissociationshastigheten för den slutliga acetatliganden från joden ökas på grund av hydroxylgruppens elektrondonerande förmåga (sålunda försvagar I-OAc-bindningen).
Kemoselektivitet
Med standard Dess-Martin periodinane betingelser kan alkoholer oxideras till aldehyder/ketoner utan att påverka furanringar , sulfider , vinyletrar och sekundära amider . Allylalkoholer oxideras lätt med DMP, som vanligtvis är svåra att omvandla till sina respektive karbonyler med de typiska oxidationsmedel.
Myers och medarbetare fastställde att DMP kunde oxidera N-skyddade aminoalkoholer utan epimerisering (till skillnad från de flesta andra oxidanter, inklusive Swern-oxidation). Dessa skyddade aminoalkoholer kan vara mycket viktiga inom läkemedelsindustrin.
Bensyl- och allylalkoholer reagerar snabbare än mättade alkoholer, medan DMP oxiderar aldoximer och ketoximer till deras respektive aldehyder och ketoner, snabbare än en primär, sekundär eller bensylalkohol till sin respektive karbonyl.
Ett exempel på Dess-Martin-oxidationen innebär att en känslig α-β-omättad alkohol transformeras till motsvarande aldehyd. Denna del har hittats i flera naturliga produkter och på grund av dess höga funktionalitet kan den vara en värdefull syntetisk byggsten i organisk syntes. Thongsornkleeb och Danheiser oxiderade denna känsliga alkohol genom att använda Dess Martin Oxidation och ändra upparbetningsproceduren (spädning med pentaner, tvättning med poly( 4-vinylpyridin ) för att avlägsna ättiksyran som genererades under reaktionen, filtrering och koncentrering via destillation.
t -Butyl DMP
Difluor- och monofluoralkoholer är svårare att oxidera. Swernoxidation har använts, men ett stort överskott av oxidationsmedlet behövde användas och gav i vissa fall inte reproducerbara resultat. Linderman och Graves fann att DMP var framgångsrikt i de flesta fall men kunde inte tolerera närvaron av nukleofila funktionella grupper i alkoholen, eftersom dessa reagerade med DMP genom att ersätta acetat. Användning av föreningen som visas nedan gav de önskade karbonylerna i höga utbyten eftersom tillsatsen av tert-butoxigruppen, på grund av dess steriska bulk , minimerar dessa sidoreaktioner.
Se även
- Alkoholoxidation
- Pyridiniumklorkromat
- Jones oxidation
- Oppenauer oxidation
- Pfitzner-Moffatt-oxidation
- Parikh-Doering oxidation
- Albright-Goldman oxidation
- Swern oxidation
- Corey-Kim oxidation
- Ley-oxidation ( TPAP- oxidation)
- TEMPO oxidation






