Bariumferrat

|
|||
|
|
|||
| Namn | |||
|---|---|---|---|
|
IUPAC namn
Bariumferrat(VI)
|
|||
| Andra namn Bariumferrat(2-)
|
|||
| Identifierare | |||
|
3D-modell ( JSmol )
|
|||
| ChemSpider | |||
|
|||
|
|||
| Egenskaper | |||
| BaFeO 4 | |||
| Molar massa | 257,1646 g/mol | ||
| Utseende | Mörkröda, ogenomskinliga kristaller | ||
| olöslig | |||
| Strukturera | |||
| ortorombisk | |||
| Pnma, nr 62 | |||
|
Om inte annat anges ges data för material i standardtillstånd (vid 25 °C [77 °F], 100 kPa).
|
|||
Bariumferrat är den kemiska föreningen med formeln BaFeO 4 . Detta är en sällsynt förening som innehåller järn i +6 oxidationstillstånd . Ferrat(VI)jonen har två oparade elektroner, vilket gör den paramagnetisk . Den är isostrukturell med BaSO 4 och innehåller den tetraedriska [FeO 4 ] 2− anjonen.
Strukturera
Ferrat (VI) -anjonen är paramagnetisk på grund av sina två oparade elektroner och den har en tetraedrisk molekylär geometri .
Röntgendiffraktion har använts för att bestämma den ortorombiska enhetscellstrukturen (gittervektorer a ≠ b ≠ c, interaxiella vinklar α=β=γ=90°) för nanokristallin BaFeO 4 . Det kristalliserade i Pnma -rymdgruppen (punktgrupp: D 2h ) med gitterparametrarna a = 0,8880 nm, b = 0,5512 nm och c = 0,7214 nm. Noggrannheten hos röntgendiffraktionsdata har verifierats av gitterfransintervallen från High-Resolution Transmission Electron Microscopy (HRTEM) och cellparametrar beräknade från Selected Area Diffraction (SAED).
Karakterisering
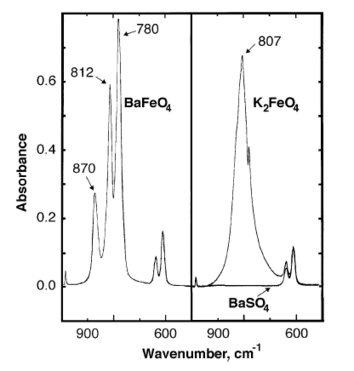
Infraröda absorbanstoppar för bariumferrat observeras vid 870, 812, 780 cm- 1 .
BaFeO 4 följer Curie–Weiss-lagen och har ett magnetiskt moment på (2,92 ± 0,03) × 10 −23 Am 2 (3,45 ± 0,1 BM ) med en Weiss-konstant på -89 K.
Beredning och kemi
Bariumferrat(VI) kan framställas med både våta och torra syntetiska metoder. Torr syntes utförs vanligtvis med användning av en termisk teknik, såsom genom att värma bariumhydroxid och järn(II)hydroxid i närvaro av syre till cirka 800 till 900 °C.
-
Ba(OH)
Fe 2
+ H2O
+ ) ( OH
2 + O2
BaFeO4 → 2
Våta metoder använder både kemiska och elektrokemiska tekniker. Till exempel bildas ferratanjonen när ett lämpligt järnsalt placeras i alkaliska förhållanden och ett starkt oxidationsmedel , såsom natriumhypoklorit , tillsätts.
- 2 Fe(OH)
3 + 3 OCl −
+ 4 OH −
→ 2 FeO
2− 4 + 5 H
2 O + 3 Cl −
Bariumferrat fälls sedan ut från lösningen genom att tillsätta en lösning av ett barium(II) salt. Tillsats av ett lösligt bariumsalt till en alkalimetallferratlösning ger en rödbrun fällning av bariumferrat, en kristall som har samma struktur som bariumkromat och har ungefär samma löslighet. Bariumferrat har också framställts genom att tillsätta bariumoxid till en blandning av natriumhypoklorit och järnnitrat vid rumstemperatur (eller 0 °C). Produktens renhet kan förbättras genom att utföra reaktionen vid låg temperatur i frånvaro av koldioxid och genom att snabbt filtrera och torka fällningen, vilket minskar samutfällningen av bariumhydroxid och bariumkarbonat som föroreningar .
Används
Bariumferrat är ett oxidationsmedel och används som ett oxiderande reagens i organiska synteser. Dess andra applikationer inkluderar avlägsnande av färg, avlägsnande av cyanid, dödande av bakterier och förorenat och avloppsvattenrening.
Salter av ferrat(VI) är energiska katodmaterial i "superjärn"-batterier. Katoder som innehåller ferrat(VI)-föreningar hänvisas till som "superjärn"-katoder på grund av deras starkt oxiderade järnbas, multipelelektronöverföring och höga inre energi. alkaliska batteriers högeffektsdomän .
Reaktioner
Bariumferrat är den mest stabila av ferrat(VI)-föreningarna. Den kan framställas i sitt renaste tillstånd och har den mest bestämda sammansättningen. Bariumferrat kan lätt sönderdelas av alla lösliga syror, inklusive kolsyra. Om koldioxid passerar genom vatten på vilket hydratiserat bariumferrat är suspenderat, kommer bariumferrat att sönderdelas fullständigt för att bilda bariumkarbonat, järnhydroxid och syrgas. Alkaliska sulfater bryter ner bariumferrat som inte har torkats och bildar bariumsulfat, järnhydroxid och syrgas.