4-nitroanilin
|
|
|||

|
|||
| Namn | |||
|---|---|---|---|
|
Föredraget IUPAC-namn
4-nitroanilin |
|||
|
Systematiskt IUPAC-namn
4-nitrobensenamin |
|||
| Andra namn p -Nitroanilin 1-Amino-4-nitrobensen p- Nitrofenylamin |
|||
| Identifierare | |||
|
3D-modell ( JSmol )
|
|||
| 508690 | |||
| ChEBI | |||
| ChEMBL | |||
| ChemSpider | |||
| ECHA InfoCard | 100.002.555 | ||
| EG-nummer |
|
||
| 27331 | |||
| KEGG | |||
|
PubChem CID
|
|||
| RTECS-nummer |
|
||
| UNII | |||
| FN-nummer | 1661 | ||
|
CompTox Dashboard ( EPA )
|
|||
|
|||
|
|||
| Egenskaper | |||
| C6H6N2O2 _ _ _ _ _ _ _ | |||
| Molar massa | 138,12 g/mol | ||
| Utseende | gult eller brunt pulver | ||
| Odör | svag, ammoniakliknande | ||
| Densitet | 1,437 g/ml, fast | ||
| Smältpunkt | 146 till 149 °C (295 till 300 °F; 419 till 422 K) (lit.) | ||
| Kokpunkt | 332 °C (630 °F; 605 K) | ||
| 0,8 mg/ml vid 18,5 °C (IPCS) | |||
| Ångtryck | 0,00002 mmHg (20°C) | ||
| -66,43 ·10 -6 cm3 /mol | |||
| Faror | |||
| Arbetsmiljö och hälsa (OHS/OSH): | |||
|
Huvudsakliga faror
|
Toxisk | ||
| GHS- märkning : | |||
 
|
|||
| Varning | |||
| H301 , H311 , H331 , H373 , H412 | |||
| P260 , P261 , P264 , P270 , P271 , P273 , P280 , P301+P310 , P302 + P352 , P304 +P340 , P311 , P312 , P314 , P321 , P321 , P321 , P321 , P321 , P321 , P403 +P233 , P405 , P501 | |||
| NFPA 704 (branddiamant) | |||
| Flampunkt | 199 °C (390 °F; 472 K) | ||
| Dödlig dos eller koncentration (LD, LC): | |||
|
LD 50 ( mediandos )
|
3249 mg/kg (råtta, oral) 750 mg/kg (råtta, oral) 450 mg/kg (marsvin, oral) 810 mg/kg (mus, oral) |
||
| NIOSH (USA:s hälsoexponeringsgränser): | |||
|
PEL (tillåtet)
|
TWA 6 mg/m3 (1 ppm) [hud] | ||
|
REL (rekommenderas)
|
TWA 3 mg/m 3 [hud] | ||
|
IDLH (Omedelbar fara)
|
300 mg/m 3 | ||
| Säkerhetsdatablad (SDS) | JT Baker | ||
| Besläktade föreningar | |||
|
Besläktade föreningar
|
2-nitroanilin , 3-nitroanilin | ||
|
Om inte annat anges ges data för material i standardtillstånd (vid 25 °C [77 °F], 100 kPa).
|
|||
4-nitroanilin , p-nitroanilin eller 1-amino-4-nitrobensen är en organisk förening med formeln C 6 H 6 N 2 O 2 . En gul fast substans, det är en av tre isomerer av nitroanilin. Det är en mellanprodukt i produktionen av färgämnen, antioxidanter, läkemedel, bensin, tandköttshämmare, fjäderfäläkemedel och som en korrosionsinhibitor.
Syntes
4-Nitroanilin framställs industriellt via amineringen av 4-nitroklorbensen :
- ClC 6 H 4 NO 2 + 2 NH 3 → H 2 NC 6 H 4 NO 2 + NH 4 Cl
Nedan är en laboratoriesyntes av 4-nitroanilin från anilin . Nyckelsteget i denna reaktionssekvens är en elektrofil aromatisk substitution för att installera nitrogruppen para till aminogruppen. Aminogruppen kan lätt protoneras och bli en metadirektör. Därför krävs ett skydd av acetylgruppen. Efter denna reaktion måste en separation utföras för att avlägsna 2-nitroanilin, som också bildas i en liten mängd under reaktionen.
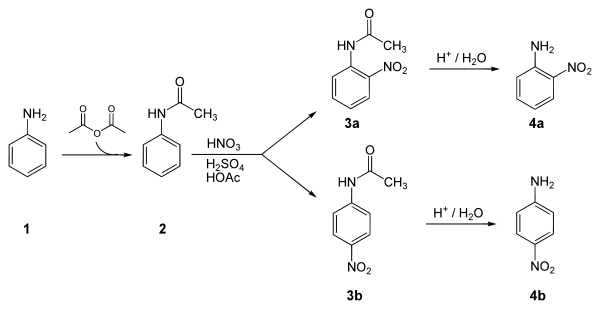
Ansökningar
4-Nitroanilin konsumeras huvudsakligen industriellt som en prekursor till p -fenylendiamin , en viktig färgämneskomponent. Reduktionen utförs med användning av järnmetall och genom katalytisk hydrering.
Det är ett utgångsmaterial för syntesen av Para Red , det första azofärgämnet :
Laboratorieanvändning
Nitroanilin genomgår diazotering , vilket ger tillgång till 1,4-dinitrobensen och nitrofenylarsonsyra. Med fosgen omvandlas det till 4- nitrofenylisocyanat .
Demonstration av kolorm
När den värms upp med svavelsyra torkar den ut och polymeriserar explosivt till ett styvt skum.
I Carbon snake- demo kan paranitroanilin användas istället för socker, om experimentet tillåts fortsätta under ett obligatoriskt dragskåp . Med den här metoden är reaktionsfasen innan den svarta ormen uppträder längre, men när den är färdig reser sig den svarta ormen själv från behållaren mycket snabbt. Denna reaktion kan orsaka en explosion om för mycket svavelsyra används.
Giftighet
Substansen är giftig genom inandning, förtäring och absorption och bör hanteras med försiktighet. Dess LD 50 hos råttor är 750,0 mg/kg vid oral administrering. 4-Nitroanilin är särskilt skadligt för alla vattenlevande organismer och kan orsaka långvariga skador på miljön om det släpps ut som en förorening.
Se även
- ^ a b c d NIOSH Pocket Guide till kemiska faror. "#0449" . Nationella institutet för arbetarskydd och hälsa ( NIOSH).
- ^ "p-Nitroanilin" . Omedelbart farliga för liv eller hälsa Koncentrationer (IDLH) . Nationella institutet för arbetarskydd och hälsa ( NIOSH).
- ^ a b c Gerald Booth (2007). Ullmanns Encyclopedia of Industrial Chemistry . Weinheim: Wiley-VCH. doi : 10.1002/14356007.a17_411 .
- ^ Mohrig, JR; Morrill, TC; Hammond, CN; Neckers, DC (1997). "Synthesis 5: Synthesis of the Dye Para Red from Anilin" . Experimentell organisk kemi . New York, NY: Freeman. s. 456–467. Arkiverad från originalet 2020-09-15 . Hämtad 2007-07-18 .
- ^ Williamson, Kenneth L. (2002). Organiska experiment i makroskala och mikroskala, fjärde upplagan . Houghton-Mifflin . ISBN 0-618-19702-8 .
- ^ EB Starkey (1939). " p -dinitrobensen". Org. Synth . 19 : 40. doi : 10.15227/orgsyn.019.0040 .
- ^ "P-NITROFENYLARSONSYRA". Organiska synteser . 26 : 60. 1946. doi : 10.15227/orgsyn.026.0060 .
-
^
RL Shriner, WH Horne och RFB Cox (1934). "p-nitrofenylisocyanat". Organiska synteser . 14 : 72. doi : 10.15227/orgsyn.014.0072 .
{{ citera tidskrift }}: CS1 underhåll: flera namn: lista över författare ( länk ) - ^ "2,6-DIIODO-p-NITROANILINE". Organiska synteser . 12 : 28. 1932. doi : 10.15227/orgsyn.012.0028 .
- ^ Poshkus, AC; Parker, JA (1970). "Studier om nitroanilin-svavelsyrakompositioner: Afrogena pyrostater". Journal of Applied Polymer Science . 14 (8): 2049–2064. doi : 10.1002/app.1970.070140813 .
- ^ Summerlin, Lee R.; Ealy, James L. (1988). "Experiment 100: Dehydrering av p-nitroanilin: Sanke och Puff". Chemical Demonstrations: A Sourcebook for Teachers Volym 1 (2:a upplagan). American Chemical Society . sid. 171. ISBN 978-0-841-21481-1 .
- ^ "Carbon Snake: demonstrerar uttorkningskraften hos koncentrerad svavelsyra" . communities.acs.org . 2013-06-06 . Hämtad 2022-01-31 .
- ^ Att göra en kolorm med P-Nitroanilin , hämtad 2022-01-31
- ^ "4-Nitroanilin" . St Louis, Missouri: Sigma-Aldrich. 18 december 2020.



