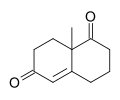
Wieland–Miescher keton
|
|
| Namn | |
|---|---|
|
Föredraget IUPAC-namn
- metyl-3,4,8,8a-tetrahydronaftalen-1,6(2H , 7H )-dion |
|
| Identifierare | |
|
3D-modell ( JSmol )
|
|
| ChemSpider | |
| ECHA InfoCard | 100.039.497 |
|
PubChem CID
|
|
| UNII | |
|
CompTox Dashboard ( EPA )
|
|
|
|
|
|
| Egenskaper | |
| C11H14O2 _ _ _ _ _ | |
| Molar massa | 178,23 g/mol |
| Smältpunkt | 47 till 50 °C (117 till 122 °F; 320 till 323 K) |
|
Om inte annat anges ges data för material i standardtillstånd (vid 25 °C [77 °F], 100 kPa).
|
|
Wieland -Miescher-ketonen är en racemisk bicyklisk diketon (enedion) och är en mångsidig synton som hittills har använts i den totala syntesen av mer än 50 naturliga produkter, främst seskviterpenoider , diterpener och steroider med möjliga biologiska egenskaper inklusive anticancer, antimikrobiella, antivirala, antineurodegenerativa och immunmodulerande aktiviteter. Reagenset är uppkallat efter två kemister från Ciba Geigy , Karl Miescher och Peter Wieland (inte att förväxla med Heinrich Otto Wieland) . Exempel på synteser utförda med användning av den optiskt aktiva enantiomeren av denna diketon som utgångsmaterial är ancistrofuran och Danishefskys totala syntes av Taxol .
De flesta framstegen inom totalsyntesmetoder med utgångspunkt från Wieland-Miescher-ketoner drevs av sökandet efter alternativa metoder för industriell syntes av preventivmedel och andra medicinskt relevanta steroider, ett forskningsområde som blomstrade på 1960- och 1970-talen. Wieland-Miescher-keton innehåller AB-ringstrukturen av steroider och är av denna anledning ett attraktivt utgångsmaterial för steroidskelettet, ett tillvägagångssätt som används i en syntes av adrenosteron .
Den ursprungliga Wieland-Miescher-ketonen är racemisk och framställd i en Robinson-annulering av 2-metyl-1,3-cyklohexandion och metylvinylketon . Mellanalkoholen är inte isolerad . En enantioselektiv syntes använder L-prolin som en organokatalysator :
Denna reaktion rapporterades 1971 av ZG Hajos och DR Parrish. I deras patent har isoleringen och karakteriseringen av den ovan avbildade optiskt aktiva bicykliska intermediära ketolen (inom parentes) också beskrivits, eftersom de arbetade vid rumstemperatur i vattenfritt dimetylformamid (DMF) lösningsmedel . Att arbeta i DMSO-lösningsmedel tillåter inte isolering av den bicykliska ketolintermediären, den leder direkt till den optiskt aktiva bicykliska dionen. Reaktionen kallas Hajos-Parrish-reaktionen eller Hajos-Parrish-Eder-Sauer-Wiechert-reaktionen .
Denna reaktion har också utförts i ett förfarande i en pott, vilket leder till 49 % utbyte och 76 % enantiomert överskott (ee) :
Andra prolinbaserade katalysatorer har undersökts.

