Hajos–Parrish–Eder–Sauer–Wiechert reaktion
Hajos – Parrish–Eder–Sauer–Wiechert-reaktionen i organisk kemi är en prolinkatalyserad asymmetrisk aldolreaktion . Reaktionen är uppkallad efter dess främsta utredare, Zoltan Hajos andra, från Hoffmann-La Roche och Schering AG . Upptäckte på 1970-talet den ursprungliga Hajos-Parrish katalytiska proceduren – visad i reaktionsekvationen, vilket leder till den optiskt aktiva bicykliska ketolen – banade vägen för asymmetrisk organokatalys . Eder-Sauer-Wiechert-modifieringen leder direkt till den optiskt aktiva enedionen, genom förlusten av vatten från den bicykliska ketolen som visas i figuren.
Det har använts flitigt som ett verktyg i syntesen av steroider och andra enantiomeriskt rena molekyler.
I den ursprungliga reaktionen som visas i figuren ovan är naturligt förekommande kiralt prolin den kirala katalysatorn i en Aldol-reaktion . Utgångsmaterialet är en akiral triketon och det kräver bara 3 % prolin för att erhålla reaktionsprodukten, en ketol i 93 % enantiomert överskott . Som visas ovan arbetade Hajos och Parrish vid omgivningstemperatur i dimetylformamid (DMF) lösningsmedel med användning av en katalytisk mängd (3 % molekvivalent) av (S)-(−)-prolin, vilket gjorde det möjligt för dem att isolera den optiskt aktiva mellanliggande bicykliska ketolen. Således beskrev de den första användningen av prolin i en katalytisk asymmetrisk aldolreaktion.
Historia
Forskning om asymmetrisk enaminkatalys som tillämpas på viktiga intermediärer i steroidsyntes beror på ett ökat intresse för effektiva och bekväma totalsynteser av steroider på 1960-talet. I synnerhet rapporterade två industrigrupper i början av 1970-talet prolinkatalyserade intramolekylära aldolreaktioner.
1971 arbetade Schering-gruppen med Escher i spetsen under icke-biologiska förhållanden med användning av (S)-prolin (47 mol%), 1N perklorsyra , i acetonitril vid 80 °C. Därför kunde de inte isolera Hajos-Parrish intermediära bicykliska ketol utan istället kondensationsprodukten (S)-7a-metyl-2,3,7,7a-tetrahydro-1H-inden-1,5(6H)-dion genom förlust av vatten. Trettiosju år senare publicerade en ny grupp vid Schering AG fortsättningen på det tidigare Schering-arbetet. Istället för de ovan nämnda icke-biologiska tillstånden använde den nya gruppen Hajos-Parrish-katalytiska förfarandet. Således kunde de isolera den optiskt aktiva 6,5-bicykliska ketolen som hittills endast beskrivits i Hajos-Parrish-publikationerna.
1974 publicerade Hajos och Parrish syntesen av bicykliska ketolintermediärer med bra utbyte och enantiomert överskott.
De undersökte ytterligare den exakta konfigurationen av den cis-fuserade-7a-metyl-6,5-bicykliska ketolen som visas i reaktionsschemat ovan genom cirkulär dikroism , och dessa resultat bekräftades av en enkristallröntgendiffraktionsstudie. Den centrosymmetriska kristallen av den motsvarande racemiska ketolen utan en tung atommärkning har erhållits genom användning av racemisk prolin. Den visade genom röntgendiffraktion en axiell orientering av den vinkelformade metylgruppen och en ekvatorial orientering av hydroxylgruppen i stolkonformatorn av den sexledade ringen. Detta stämmer väl överens med kristallstrukturen hos CD-ringen av digitoxigenin . Strukturen för denna ketol och dess etylhomolog visas enligt följande:
Liknande studier av 7a-etylhomologen visade att den etylbicykliska ketolen existerade i en cis-konformation där 7a-etylgruppen är ekvatorialt orienterad och hydroxylgruppen är axiellt orienterad i stolformen av den sexledade ringen som visas ovan . Anledningen till en preferens för denna konformation kan vara förbättrad 1,3-diaxial interaktion i den andra cis-konformatorn mellan den kantiga etylgruppen och de axiella väteatomerna vid C-4 och C-6 i den sexledade ringen.
Intermolekylära versioner
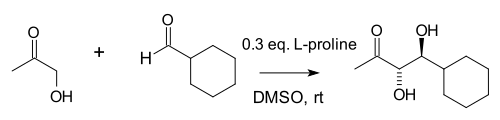
I en studie från 2000 fann Barbas-gruppen att intermolekylära aldoltillsatser (de mellan ketoner och aldehyder) också är möjliga om än med användning av betydligt mer prolin:
Författarna noterade likheten mellan prolin, aldolasantikropparna de hade skapat och naturliga aldolasenzymer aldolas A som alla verkar genom en enaminmellanprodukt . I denna reaktion undertrycker den höga koncentrationen av aceton (en av de två reaktanterna) olika möjliga bireaktioner: reaktion av ketonen med prolin till en oxazolidinon och reaktion av aldehyden med prolin till en azometin-ylid .
Notz och List fortsatte med att utöka användbarheten av denna reaktion till syntesen av 1,2-dioler:
I sin fullständiga redogörelse för sitt meddelande från 2000 avslöjade gruppen att prolin tillsammans med tiazoliumsaltet 5,5 -dimetyltiazolidinium-4-karboxylat visade sig vara de mest effektiva katalysatorerna bland en stor grupp av aminer, medan katalys med (S) -1-(2-pyrrolidinylmetyl)-pyrrolidinsalter utgjorde grunden för utvecklingen av diaminorganokatalysatorer som har visat sig effektiva i en mängd olika organokatalytiska reaktioner.
Den asymmetriska syntesen av Wieland-Miescher-ketonen (1985) är en annan intramolekylär reaktion också baserad på prolin, som undersöktes av Barbas-gruppen 2000. I denna studie visade Barbas-gruppen för första gången att prolin kan katalysera kaskaden Michael- aldolreaktion genom kombinerad iminium-enaminkatalys. Detta arbete är betydelsefullt eftersom trots den 30-åriga historien och tillämpningen av Hajos-Parrish-reaktionen i industrin, hade triketonsubstratet för denna reaktion alltid syntetiserats i ett diskret oberoende steg, vilket visar att det fanns en grundläggande brist på förståelse för kemikalien. mekanismen för denna reaktion. Barbas-gruppen hade rapporterat annulleringen av den aldolasantikroppskatalyserade iminium-enamin Robinson i sin studie från 1997 som markerade början på deras studier i det område som nu kallas organokatalys. I en rapport som publicerades 2002 Carlos F. Barbas III : "Arbetade på 1970-talet med prolinkatalyserade intramolekylära aldoladditionsreaktioner av syntetiska organiska kemister Zoltan G. Hajos och David R. Parrish vid den kemiska forskningsavdelningen vid Hoffmann-La Roche, Nutley, NJ, inspirerade oss att titta närmare på paralleller mellan småmolekylära katalysatorer och enzymer."
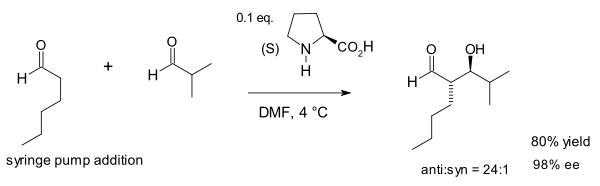
2002 var Macmillan-gruppen först med att demonstrera den prolinkatalyserade Aldol-reaktionen mellan olika aldehyder . Denna reaktion är ovanlig eftersom aldehyder i allmänhet självkondenserar.
Den organokatalytiska intermolekylära aldolreaktionen är nu känd som Barbas-List Aldol-reaktionen.
Reaktionsmekanism
Flera reaktionsmekanismer för triketonreaktionen har föreslagits under åren. Hajos och Parrish föreslog enaminmekanismen i deras papper [2] . Deras experiment med en stökiometrisk mängd märkt vatten (H 2 18 O) stödde emellertid en karbinolaminmekanism. Därför lade Hajos (1974) fram en hemiaminal mellanprodukt. [2] Agami-mekanismen (1984) har en enaminmellanprodukt med två prolinenheter involverade i övergångstillståndet ( baserat på experimentell reaktionskinetik ) och enligt en mekanism av Houk (2001) räcker en enda prolinenhet med ett cykliskt övergångstillstånd och med prolinkarboxylgruppen involverad i vätebindning .
Den hemiaminal (karbinolamin) som Hajos lade fram 1974 kan ändras till en tautomer iminiumhydroxidmellanprodukt. Den iminiumhydroxidjon som orsakade enolisering av sidokedjans metylketon skulle följas av ringslutning till den ovan visade optiskt aktiva bicykliska ketolprodukten (se figur 1.) under inverkan av den katalytiska mängden (S)-(−)-prolin . erhöll utmärkta resultat med användning av den enkla kirala primära aminen t-Bu-CH(NH2) -CH2 - NEt2.TfOH för syntesen av både Wieland-Miescher-ketonen och Hajos-Parrish-ketonen såväl som deras analoger. Detta stödjer iminiummekanismen, eftersom det är lärobokskemi att primära aminer bildar iminer snarare än enaminer med karbonylföreningar.
Hajos 1974 karbinolaminmekanism har fått ett omedvetet stöd i en nyare artikel av Michael Limbach. Triketonutgångsmaterialet 2-metyl-2-(3-oxobutyl)-1,3-cyklopentandion gav den förväntade optiskt aktiva bicykliska ketolen (+)-(3aS,7aS)-3a,4,7,7a-tetrahydro-3a- hydroxi-7a-metyl-1,5(6H)-indandion med (S)-(-)-prolinkatalysator. Å andra sidan vänds det stereokemiska resultatet med ee-selektiviteter på upp till 83 % genom att använda de homologa aminosyrakatalysatorerna, såsom (S)-β-homoprolin, [(pyrrolidin-(2S)-yl)ättiksyra]. Den virtuella anomalien kan förklaras med en ovansida av de skrymmande beta-aminosyrorna till ovanstående triketonutgångsmaterial med reflekterande symmetri. Toppsidans tillvägagångssätt resulterar i bildandet av en enantiotop karbinolamin för att ge (−)-(3aR,7aR)-3a,4,7,7a-tetrahydro-3a-hydroxi-7a-metyl-1,5(6H)- indanedionbicyklisk ketolenantiomer identisk med den som erhålls med onaturligt (R)-(+)-prolin. List 2010 å andra sidan är förbryllad och förvånad över att Hajos förkastade enaminmekanismen, säkert mot bakgrund av tidigare arbete av Spencer 1965 om aminkatalyserade aldolreaktioner. Det är intressant och överraskande att Eder, Sauer och Wiechert inte har försökt förklara reaktionsmekanismen. [3]
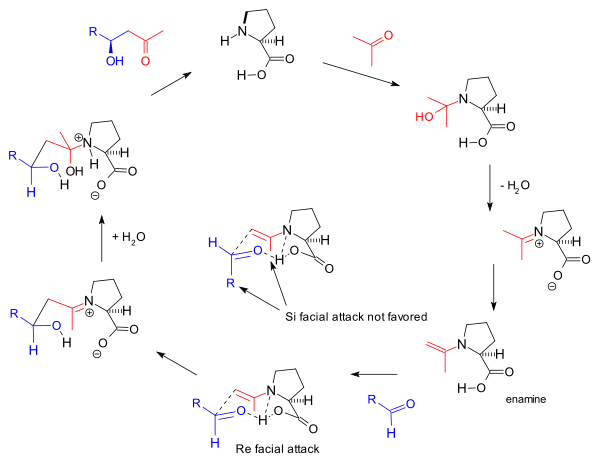
Reaktionsmekanismen som föreslogs av Barbas-gruppen 2000 för de intermolekylära reaktionerna är också baserad på enaminbildning och den observerade stereoselektiviteten baserad på Zimmerman-Traxler-modellen som gynnar Re -face -metoden. Detta är samma mekanism som föreslagits av Barbas för aldolasantikroppar som rapporterades av gruppen 1995:
Denna enaminmekanism driver också den ursprungliga triketonreaktionen från Hajos-Parrish, men inblandningen av två prolinmolekyler i den som föreslagits av Agami ifrågasätts av Barbas baserat på avsaknaden av icke-linjära effekter och stöds av senare studier av List baserad på reaktionskinetik . Den allmänna mekanismen stöds ytterligare av List av upptäckten att i en reaktion som utförs i märkt vatten (H 2 18 O) hittar syreisotopen in i reaktionsprodukten. Hajos och Parrish-experimentet med en stökiometrisk mängd märkt vatten (H 2 18 O) stödde karbinolaminmekanismen. [2]
I samma studie [20] undersöktes reaktionen mellan prolin och aceton till oxazolidinonen (i DMSO ):
Jämviktskonstanten för denna reaktion är endast 0,12 vilket leder till att Listan drar slutsatsen att involveringen av oxazolidinon endast är parasitisk .
Blackmond hittade 2004 också oxazolidinoner som intermediärer (NMR) i en relaterad prolinkatalyserad α-aminooxylering av propanal med nitrosobensen :
Chiong Teck Wong från Institute of High Performance Computing Singapore studerade liknande oxyamineringsreaktion av nitrosobensen med butanal med användning av en kiral prolinolsilyleterkatalysator . Hans studier tyder starkt på att katalysatorn genererar enolen och bildar ett enol-katalysatorkomplex. Nitsosobensen reagerar därefter med enol-katalysatorkomplexet för att ge (S)-N-nitrosoaldolprodukten i överensstämmelse med Paulings diagram över elektronegativitet. Natriumborhydridreduktion av de primärt bildade aldolprodukterna gav motsvarande alkoholer i gott utbyte och utmärkt enantioselektivitet i förhållandet P N / PO =>99:1 såsom visas i schemat nedan. Wong föreslår att reaktionsmekanismen för den (S)-Cat-katalyserade N-nitroso-aldolreaktionen mellan nitrosobensen och butanal fortskrider via en enolmellanprodukt och inte via en enaminmellanprodukt.
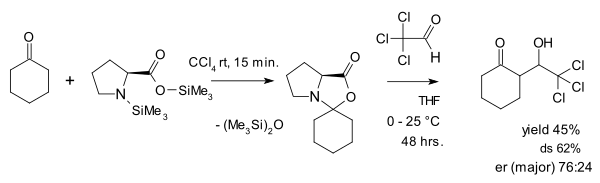
Synen på oxazolidinoner som en parasitisk art ifrågasätts av Seebach och Eschenmoser som 2007 publicerade en artikel där de hävdar att oxazolidinoner faktiskt spelar en central roll i prolinkatalys. En av sakerna de gjorde var att reagera en oxazolidinon med den aktiverade aldehydkloralen i en aldoltillsats:
2008 tog Barbas i en essä upp frågan varför det dröjde till år 2000 innan intresset återfanns för denna till synes enkla reaktion 30 år efter det banbrytande arbetet av Hajos och Parrish och varför prolinkatalysmekanismen verkade vara en gåta så länge. En förklaring har att göra med olika vetenskapliga kulturer: en prolinmekanism i samband med aldolaskatalys som redan postulerades 1964 av en biokemist ignorerades av organiska kemister. En annan del av förklaringen var den förmodade komplexiteten av aldolaskatalys som dominerade kemiskt tänkande under lång tid. Slutligen expanderade inte forskningen inom detta område vid Hoffmann-La Roche efter ZGHs avgång i november 1970.
Ursprunget till namnet på reaktionen
Namnet för denna reaktion tog lite tid att utveckla. 1985 var professor Agami och medarbetare de första att namnge den prolinkatalyserade Robinson-annulleringen Hajos-Parrish-reaktionen. 1986 kallade professor Henri B. Kagan och professor Agami det fortfarande för Hajos-Parrish-reaktionen i sammanfattningen av denna artikel. År 2001 publicerade Kagan en artikel med titeln "Icke-linjära effekter i asymmetrisk katalys: ett personligt konto" i Synlett . I denna tidning introducerade han den nya titeln Hajos-Parrish-Wiechert-reaktionen. 2002 Benjamin List till ytterligare två namn och introducerade termen Hajos–Parrish–Eder–Sauer–Wiechert-reaktion. Vetenskapliga artiklar publicerade så sent som 2008 inom området organokatalys använder antingen reaktionens namn från 1985, 2001 eller 2002. En sökning i juni 2014 begränsad till åren 2009–2014 av Google Scholar ger 44 träffar för Hajos-Parrish-reaktionen, 3 för Hajos-Parrish-Wiechert-reaktionen och 184 för Hajos-Parrish-Eder-Sauer-Wiechert-reaktionen. Termen "Hajos-Parrish keton" (och liknande) är dock fortfarande vanlig.