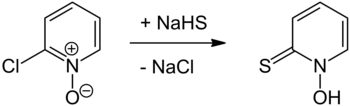Pyrition
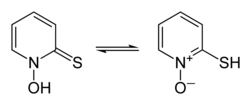 Interkonvertering av pyritiontautomerer tionform till vänster, tiolform till höger |
|
| Namn | |
|---|---|
|
Föredraget IUPAC-namn
1-hydroxi-2(1H ) -pyridintion (tion) 2-pyridinetiol 1-oxid (tiol) |
|
| Andra namn Omadintion : 1-hydroxipyridin-2-tion N -hydroxipyridin-2-tion tiol : 2-merkaptopyridinmonoxid 2-merkaptopyridin- N - oxid 2-merkaptopyridin 1-oxid |
|
| Identifierare | |
|
|
|
3D-modell ( JSmol )
|
|
| 109936 | |
| ChEBI |
|
| ChEMBL |
|
| ChemSpider | |
| DrugBank | |
| ECHA InfoCard | 100.013.027 |
| EG-nummer |
|
| 913415 | |
|
PubChem CID
|
|
| UNII | |
|
CompTox Dashboard ( EPA )
|
|
|
|
|
|
| Egenskaper | |
| C 5 H 5 N O S | |
| Molar massa | 127,16 g·mol -1 |
| Utseende | Beige kristallint pulver |
| Smältpunkt | 70 till 73 °C (158 till 163 °F; 343 till 346 K) |
| 2,5 g L -1 vid 20 °C | |
| Löslighet |
Löslig : bensen , kloroform , diklormetan , dimetylformamid , dimetylsulfoxid , etylacetat Något löslig : dietyleter , etanol , metyl- tert -butyleter , tetrahydrofuran |
| Surhet (p K a ) | −1,95 (protonaddition), 4,6 |
| Faror | |
| GHS- märkning : | |

|
|
| Fara | |
| H301 , H315 , H319 , H335 | |
| P261 , P264 , P270 , P271 , P280 , P301+P310 , P302+P352 , P304+P340 , P305+P351+P338, P312 , P321 , P332+ P330 , P330, P330, P331 , P330 , 2 , P403 + P233 , P405 , P501 | |
|
Om inte annat anges ges data för material i standardtillstånd (vid 25 °C [77 °F], 100 kPa).
|
|
Pyrithion är det vanliga namnet på en organisk svavelförening med molekylformel C
5 H
5 NOS , vald som en förkortning av pyridintion , och som finns i den persiska schalottenlöken . Den existerar som ett par tautomerer , den huvudsakliga formen är tionen 1-hydroxi-2(1H ) -pyridinetion och den mindre formen är tiol -2-merkaptopyridin- N -oxiden ; det kristalliserar i tionformen. Den framställs vanligtvis av antingen 2-brompyridin , 2-klorpyridin eller 2-klorpyridin-N-oxid, och är kommersiellt tillgänglig som både den neutrala föreningen och dess natriumsalt . Det används för att förbereda zinkpyrition , som används främst för att behandla mjäll och seborroiskt eksem i medicinska schampon , men är också ett antifouling-medel i färger.
Förberedelse
Framställningen av pyrition rapporterades första gången 1950 av Shaw och framställdes genom reaktion av 2-klorpyridin-N-oxid med natriumhydrosulfid följt av surgöring, eller mer nyligen med natriumsulfid . 2-klorpyridin- N -oxid i sig kan framställas från 2-klorpyridin med användning av perättiksyra . Ett annat tillvägagångssätt innefattar behandling av samma utgångs -N -oxid med tiokarbamid för att ge pyridyl-2-isotiouroniumklorid N -oxid som genomgår bashydrolys till pyrition. 2-Bromopyridin kan oxideras till sin N -oxid med användning av en lämplig persyra (enligt 2-klorpyridin), båda tillvägagångssätten är analoga med de som rapporteras i Organic Syntheses för oxidation av pyridin till dess N -oxid. En substitutionsreaktion med användning av antingen natriumditionit ( Na
2 S
2 O
4 ) eller natriumsulfid med natriumhydroxid kommer att tillåta ersättning av bromsubstituenten med en tiolfunktionell grupp .
Den alternativa strategin är att bilda merkaptanen innan N - oxiddelen introduceras . 2-Mercaptopyridin syntetiserades ursprungligen 1931 genom att värma 2-klorpyridin med kalciumhydrosulfid, ett tillvägagångssätt liknande det som först användes för att framställa pyrition. Den analoga tiourea-metoden via ett uroniumsalt rapporterades 1958 och ger en mer bekväm väg till 2-merkaptopyridin. Oxidation till N -oxiden kan sedan genomföras.
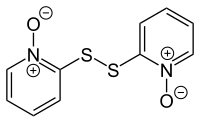
Pyrithion finns som en naturlig produkt i växten Allium stipitatum , en asiatisk lökart , även känd som den persiska schalottenlöken . Dess närvaro detekterades med hjälp av positiv jonmasspektrometri med användning av en DART-jonkälla och disulfiddipyrition ) har rapporterats från samma art. Dipyrition kan framställas i ett laboratorium genom oxidation av pyrition med klor i närvaro av natriumhydroxid :
- 2 C
5 H
4 NOSH + Cl
2 + 2 NaOH → ONC
5 H
4 –S–S–C
5 H
4 NO + 2 NaCl + 2 H
2 O
- 2 C
Dipyrithion används som en fungicid och baktericid och har rapporterats ha ny cytotoxisk aktivitet genom att inducera apoptos .
Egenskaper
Pyrithion existerar som ett par prototroper, en form av tautomerism där den snabba omvandlingen av konstitutionella isomerer innebär förskjutning av en enda proton, i detta fall mellan svavel- och syreatomerna (visas i inforutan ovan).
Salter av konjugatbasen av pyrition kan också anses uppvisa tautomerism genom att teoretiskt associera natriumjonen med vilken heteroatom som än bär den negativa laddningen av anjonen (i motsats till de formella laddningarna associerade med N -oxiden); men med tanke på anjonen ensam kan detta också beskrivas som ett exempel på resonans .
Pyrithion är en svag syra med p K a - värden på -1,95 och +4,6 (tiolproton), men är en markant starkare syra än någon av dess moderföreningar (pyridin- N -oxid och pyridin-2-tiol), som båda har p Ka > 8. Det är endast svagt lösligt i vatten (2,5 g L −1 ) men är lösligt i många organiska lösningsmedel (inklusive bensen , kloroform , diklormetan , dimetylformamid , dimetylsulfoxid och etylacetat ) och lätt löslighet i andra ( dietyleter , etanol , metyl - tert -butyleter och tetrahydrofuran ).
Pyrition kan användas som en källa för hydroxylradikal i organisk syntes eftersom den fotokemiskt sönderdelas till H2O och (pyridin-2-yl)sulfanylradikal.
Ansökningar
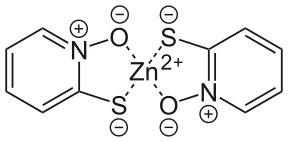
Strukturer av 1:2-komplex av zink och den konjugerade basen av pyrition Topp : Strukturformel för monomeren Nederst : Kul-och-stick-modell av dimeren
Den konjugerade basen av pyrition (pyritionatjon) är en anjon som innehåller två donatoratomer , en svavelatom och en syreatom som var och en har en negativ formell laddning ; kväveatomen förblir formellt positivt laddad. Tiolatanjonen kan bildas genom reaktion med natriumkarbonat, och zinkpyrition bildas när zinkklorid tillsätts. Anjonen kan fungera som antingen en entandad eller tvåtandad ligand och bildar ett 1:2- komplex med ett zink(II)-metallcentrum. Zinkpyrition har använts sedan 1930-talet även om dess framställning inte avslöjades förrän i ett brittiskt patent från 1955 där pyrition reagerades direkt med hydratiserat zinksulfat i etanol. I sin monomera form har zinkpyrithion två av anjonerna kelerade till ett zinkcentrum med en tetraedrisk geometri . I fast tillstånd bildar den en dimer där varje zinkcentrum antar en trigonal bipyramidal geometri med två av anjonerna som fungerar som överbryggande ligander koordinerade genom syreatomerna i de axiella positionerna. I lösning dissocierar dimererna via klyvning av zink-syrebindningar till varje överbryggande ligand. Ytterligare dissociation av monomeren till dess beståndsdelar kan inträffa och är oönskad eftersom komplexet är mer potent i medicinska tillämpningar; av detta skäl zinkkarbonat tillsättas till formuleringar eftersom det hämmar monomerdissociationen.
Zinkpyrithion har en lång historia av användning i medicinska schampon för att behandla mjäll och seborroiskt eksem (mjäll kan betraktas som en mild form av seborroiskt eksem). Den uppvisar både svampdödande och antimikrobiella egenskaper, och hämmar Malassezia -jästsvamparna som främjar dessa hårbottentillstånd. De mekanismer genom vilka detta arbete är föremål för pågående studier. Det kan användas som ett antibakteriellt medel mot Staphylococcus och Streptococcus infektioner för tillstånd som fotsvamp, eksem, psoriasis och ringorm. Det är känt för att vara cytotoxiskt mot Pityrosporum ovale , särskilt i kombination med ketokonazol , som är den föredragna formuleringen för seborroiskt eksem. Pyrithion i sig hämmar membrantransportprocesser i svampar.
Färger som används i yttre miljöer innehåller ibland zinkpyrition som ett förebyggande skydd mot alger och mögel.