Praseodymiumföreningar
Praseodymiumföreningar är föreningar som bildas av lantanidmetallen praseodym (Pr) . I dessa föreningar uppvisar praseodym i allmänhet +3- oxidationstillståndet , såsom PrCl3 , Pr(NO3 ) 3 och Pr( CH3COO ) 3 . Emellertid är föreningar med praseodym i +2 och +4 oxidationstillstånd, och till skillnad från andra lantanider , +5 oxidationstillstånd, också kända.
Oxider
Praseodym kan bilda oxider på många olika sätt, även om de enda oxiderna som är stabila vid rumstemperatur är Pr 2 O 3 , Pr 6 O 11 och PrO 2 . Praseodymium(III)oxid är ett grönt pulver som bildar hexagonala kristaller och kristalliserar i mangan(III)oxid- eller bixbyitstrukturen . Praseodym(IV)oxid kan framställas genom att koka Pr 6 O 11 i vatten eller ättiksyra :
- Pr 6 O 11 + 3 H 2 O → 4 PrO 2 + 2 Pr(OH) 3
Praseodym(III,IV)oxid är den mest stabila formen av praseodymoxiderna vid omgivande temperatur och tryck. Det är lösligt i vatten och har en kubisk fluoritstruktur . Det kan framställas via fasta tillståndsmetoder såsom termolys, smältsaltmetod, kalcinering eller utfällning .
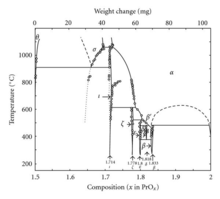
Förutom Pr 6 O 11 bildar praseodym också ett system av oxider i olika faser:
| Värde | Formel | Fas | x i PrO x | Genomsnittligt oxidationstillstånd för Pr |
|---|---|---|---|---|
| 4 | Pr 2 O 3 | θ | 1.5 | 3 |
| 7 | Pr 7 O 12 | ι | 1,714 | 3,428 |
| 9 | Pr 9 O 16 | ζ | 1,778 | 3,556 |
| 10 | Pr 5 O 9 | ε | 1.8 | 3.6 |
| 11 | Pr 11 O 20 | δ | 1,818 | 3,636 |
| 12 | Pr 6 O 11 | β | 1,833 | 3,667 |
| ∞ | PrO 2 | 2 | 4 |
Halider
Praseodymiummetall reagerar med alla stabila halogener för att bilda gröna trihalider:
- 2 Pr (s) + 3 F 2 (g) → 2 PrF 3 (s)
- 2 Pr (s) + 3 Cl 2 (g) → 2 PrCl 3 (s)
- 2 Pr (s) + 3 Br 2 (g) → 2 PrBr 3 (s)
- 2 Pr (s) + 3 I 2 (g) → 2 PrI 3 (s)
Praseodymium(III)fluorid är den mest stabila fluoriden av praseodym. Det kan beredas reaktionen mellan praseodymium(III)nitrat och natriumfluorid kommer att producera praseodymium(III)fluorid som ett grönt kristallint fast ämne. Praseodymium(III)klorid är en ljusgrön fast substans som kan framställas genom att behandla praseodymmetall med väteklorid . Det renas vanligtvis genom vakuumsublimering. Den är Lewis-syra , klassad som "hård" enligt HSAB-konceptet . Snabb uppvärmning av hydratet kan orsaka små mängder hydrolys . PrCl3 bildar ett stabilt Lewis - syra -baskomplex K2PrCl5 genom reaktion med kaliumklorid ; denna förening visar intressanta optiska och magnetiska egenskaper.
Praseodymium(III)bromid är den enda stabila bromiden av praseodym. Den antar UCl 3- kristallstrukturen. Praseodymiumjonerna är 9-koordinater och antar en trigonal prismatisk geometri med tre toppar . Bindningslängderna praseodym-brom är 3,05 Å och 3,13 Å. Praseodym(III)jodid kan framställas genom att värma praseodym och jod i en inert atmosfär ger praseodym(III)jodid, eller genom att värma praseodym med kvicksilver(II)jodid. Det bildar ortorombiska kristaller som är hygroskopiska . Den kristalliserar i PuBr 3 -typen med rymdgruppen Cmcm (nr 63) med a = 4,3281(6) Å, b = 14,003(6) Å och c = 9,988(3) Å.
Tetrafluoriden , PrF4 ger , är också känd och framställs genom att en blandning av natriumfluorid och praseodymium(III)fluorid reageras med fluorgas , vilket Na2PrF6 , varefter natriumfluorid avlägsnas från reaktionsblandningen med flytande vätefluorid . . Dessutom bildar praseodym en bronsdijodid ; liksom dijodiderna av lantan, cerium och gadolinium är det en praseodymium(III) -elektridförening .
Organopraseodymiumföreningar
Organopraseodymiumföreningar är föreningar med en praseodym - till- kolbindning . Dessa föreningar är mycket lika de hos de andra lantaniderna , eftersom de alla delar en oförmåga att genomgå π-backbonding . De är sålunda mestadels begränsade till de mestadels joniska cyklopentadieniderna (isostrukturella med de av lantan) och de σ-bundna enkla alkylerna och arylen, av vilka några kan vara polymera. Koordinationskemin för praseodymium är till stor del den för den stora, elektropositiva Pr 3+ -jonen, och liknar sålunda i stort sett den hos de andra tidiga lantaniderna La 3+ , Ce 3+ och Nd 3+ . Till exempel, liksom lantan, cerium och neodym, praseodymiumnitrat både 4:3- och 1:1-komplexen med 18-krona-6 , medan de mellersta lantaniderna från prometium till gadolinium endast kan bilda 4:3-komplexet och det senare lantanider från terbium till lutetium kan inte framgångsrikt koordinera till alla ligander. Sådana praseodymkomplex har höga men osäkra koordinationstal och dåligt definierad stereokemi, med undantag som är ett resultat av exceptionellt skrymmande ligander såsom trikoordinaten [Pr{N(SiMe 3 ) 2 } 3 ] . Det finns också några blandade oxider och fluorider som involverar praseodymium(IV), men det har inte en märkbar koordinationskemi i detta oxidationstillstånd som dess granne cerium. Det första exemplet på ett molekylärt komplex av praseodym(IV) har dock nyligen rapporterats. Liksom de andra organolantanidföreningarna inkluderar egenskaperna hos organopraseodymiumföreningar:
- Organopraseodymiumföreningar är mycket luft- och vattenkänsliga och pyrofora .
- Kemi i 0- oxidationstillståndet är mycket mer begränsad. Faktum är att deras elektropositiva natur gör att deras organometalliska föreningar är mer benägna att vara joniska.
- Organopraseodymiumföreningar bildar inga stabila karbonyler vid rumstemperatur; organopraseodymiumkarbonylföreningar har endast observerats i argonmatriser och sönderdelas vid upphettning till 40 K .
σ-bundna komplex
Metall-kol σ-bindningar finns i alkyler av praeodymium såsom [PrMe 6 ] 3− och Pr[CH(SiMe 3 ) 2 ] 3 .
π-bundna komplex
Cyklopentadienylkomplex är kända för praseodym. Det kan produceras med följande reaktionsschema:
- 3 Na[Cp] + PrCl3 → Pr[Cp] 3 + 3 NaCl
Dessa föreningar är av begränsad användning och akademiskt intresse.
Ansökningar
Praseodymium(III)nitrid används i avancerade el- och halvledarprodukter och som råmaterial för att producera fosfor. Det används också som magnetiskt material och sputterande målmaterial. Många praseodymföreningar, såsom praseodymium(III)oxalat , används för att färga vissa glas och emaljer. Om det blandas med vissa andra material, målar praseodymium(III)oxalat glaset intensivt gult.
Praseodymium(III,IV)oxid har ett antal potentiella tillämpningar i kemisk katalys och används ofta tillsammans med en promotor som natrium eller guld för att förbättra dess katalytiska prestanda. Den har en hög-K dielektrisk konstant på cirka 30 och mycket låga läckströmmar vilket också har gjort det till ett lovande material för många potentiella applikationer inom nanoenheter och mikroelektronik .