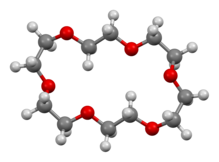
18-Crown-6

|
|
|
|

|
|
| Namn | |
|---|---|
|
Föredraget IUPAC-namn
1,4,7,10,13,16-hexaoxacyklooktadekan |
|
| Identifierare | |
|
3D-modell ( JSmol )
|
|
| 1619616 | |
| ChEBI | |
| ChEMBL | |
| ChemSpider | |
| ECHA InfoCard | 100.037.687 |
| EG-nummer |
|
| 4535 | |
|
PubChem CID
|
|
| UNII | |
|
CompTox Dashboard ( EPA )
|
|
|
|
|
|
| Egenskaper | |
| C12H24O6 _ _ _ _ _ | |
| Molar massa | 264,315 g/mol |
| Densitet | 1,237 g/cm 3 |
| Smältpunkt | 37 till 40 °C (99 till 104 °F; 310 till 313 K) |
| Kokpunkt | 116 °C (241 °F; 389 K) (0,2 Torr) |
| 75 g/L | |
| Faror | |
| GHS- märkning : | |

|
|
| Varning | |
| H302 , H315 , H319 , H335 | |
| P261 , P264 , P270 , P271 , P280 , P301+P312 , P302+P352 , P304+P340 , P305+ P351+P338, P312 , P321 , P332+ P330 , P330, P331 , P330 + P31 , P330+ 2 , P403 + P233 , P405 , P501 | |
| Besläktade föreningar | |
|
Besläktade föreningar
|
Dibenzo-18-crown-6 Triglyme Hexaaza-18-crown-6 |
|
Om inte annat anges ges data för material i standardtillstånd (vid 25 °C [77 °F], 100 kPa).
|
|
18-Crown-6 är en organisk förening med formeln [C2H4O ] 6 och IUPAC - namnet 1,4,7,10,13,16-hexaoxacyklooktadekan. Det är ett vitt, hygroskopiskt kristallint fast ämne med låg smältpunkt. Liksom andra kronetrar fungerar 18-krona-6 som en ligand för vissa metallkatjoner med en speciell affinitet för kaliumkatjoner ( bindningskonstant i metanol : 10 6 M -1 ). Punktgruppen för 18-krona-6 är S6 . Dipolmomentet för 18-krona-6 varierar i olika lösningsmedel och under olika temperaturer. Under 25 °C är dipolmomentet för 18-krona-6 2,76 ± 0,06 D i cyklohexan och 2,73 ± 0,02 i bensen. Syntesen av kronetrarna ledde till att Charles J. Pedersen tilldelades Nobelpriset i kemi .
Syntes
Denna förening framställs genom en modifierad Williamson-etersyntes i närvaro av en schablonkatjon: Den kan också framställas genom oligomerisering av etylenoxid :
- (CH 2 OCH 2 CH 2 Cl) 2 + (CH 2 OCH 2 CH 2 OH) 2 + 2 KOH → (CH 2 CH 2 O) 6 + 2 KCl + 2 H 2 O
Den kan renas genom destillation , där dess tendens att underkyla blir tydlig. 18-Crown-6 kan också renas genom omkristallisation från varm acetonitril . Det bildar initialt ett olösligt solvat. Rigoröst torrt material kan framställas genom att lösa föreningen i THF följt av tillsats av NaK för att ge [K(18-krona-6)]Na, ett alkalisalt .
Kristallografisk analys avslöjar en relativt platt molekyl men en där syrecentra inte är orienterade i den idealiserade 6-faldiga symmetriska geometrin som vanligtvis visas. Molekylen genomgår betydande konformationsförändring vid komplexbildning.
Reaktioner
18-Crown-6 har en hög affinitet för hydroniumjonen H 3 O + , eftersom den kan passa inuti kronetern. Således ger reaktion av 18-crown-6 med starka syror katjonen . Till exempel ger interaktion av 18-krona-6 med HCl-gas i toluen med lite fukt ett joniskt vätskeskikt med sammansättningen fasta kan isoleras vid stående. Reaktion av det joniska vätskeskiktet med två molekvivalenter vatten ger den kristallina produkten .
Ansökningar
18-Crown-6 binder till en mängd olika små katjoner och använder alla sex syrgaser som donatoratomer. Kronetrar kan användas i laboratoriet som fasöverföringskatalysatorer . Salter som normalt är olösliga i organiska lösningsmedel görs lösliga med kroneter. Till exempel kaliumpermanganat i bensen i närvaro av 18-krona-6, vilket ger den så kallade "lila bensenen", som kan användas för att oxidera olika organiska föreningar.
Olika substitutionsreaktioner accelereras också i närvaro av 18-krona-6, vilket undertrycker jonparning. Anjonerna blir därmed nakna nukleofiler . Till exempel, med 18-krona-6, kaliumacetat en mer kraftfull nukleofil i organiska lösningsmedel:
- [K(18-krona-6) + ]OAc − + C 6 H 5 CH 2 Cl → C 6 H 5 CH 2 OAc + [K(18-krona-6) + ] Cl −
Det första elektridsaltet som undersöktes med röntgenkristallografi , [Cs(18-crown-6) 2 ] + · e − , syntetiserades 1983. Detta mycket luft- och fuktkänsliga fasta ämne har en sandwichmolekylstruktur, där elektronen fångas i nästan sfäriska gitterhåligheter. Det kortaste elektron-elektronavståndet är dock för långt (8,68 Å) för att göra detta material till en ledare av elektricitet.
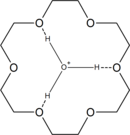
![{\displaystyle {\ce {[H3O.18-crown-6]+}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/05959c612544dc9b3cb3553c23497b6cb0b79eae)
![{\displaystyle {\ce {[H3O.18-crown-6]+[HCl2]^{-}.}}3.8{\ce {C6H5Me}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/f6c99a07eb7055bb324034bb06c5b326acac2040)
![{\displaystyle {\ce {[H3O.18-crown-6]+[HCl2]-}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/4a39f9fa425e04e4fb9893a6534ec9ebe14ec13d)
![{\displaystyle {\ce {(H5O2)[H3O.18-crown-6]Cl2}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/ea4d202cf03dca6460e22c323e76cdeaa4e4da33)
