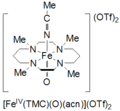Högvärdigt järn
Högvärdigt järn betecknar vanligtvis föreningar och intermediärer där järn finns i ett formellt oxidationstillstånd > 3 som visar ett antal bindningar > 6 med ett koordinationstal ≤ 6. Termen är ganska ovanlig för hepta-koordinatföreningar av järn. Det måste särskiljas från termerna hypervalent och hyperkoordinat , eftersom högvärda järnföreningar varken nödvändigtvis bryter mot 18-elektronregeln eller nödvändigtvis visar koordinationstal > 6. Ferrat(VI) jonen [FeO 4 ] 2− var den första strukturen i denna klass syntetiseras. De syntetiska föreningar som diskuteras nedan innehåller i allmänhet starkt oxiderat järn, eftersom begreppen är nära besläktade.
Oxojärnföreningar
00 Oxoferryl-arter föreslås vanligtvis som mellanprodukter i katalytiska cykler , speciellt biologiska system där O2- aktivering krävs. Diatomiskt syre har en hög reduktionspotential (E = 1,23 V), men det första steget som krävs för att utnyttja denna potential är en termodynamiskt ogynnsam enelektronsreduktion E = -0,16 V. Denna reduktion sker i naturen genom bildningen av ett superoxidkomplex i vilket en reducerad metall oxideras av O 2 . Produkten av denna reaktion är en peroxidradikal som är mer lättreaktiv. En allmänt användbar metod för generering av högvärdiga oxoferrylspecies är oxidation med jodosobensen :
- symbolisk oxidation av en järnförening med jodosobensen ; L betecknar den bärande liganden
Fe(IV)O
Flera synteser av oxoiron(IV)-arter har rapporterats. Dessa föreningar modellerar biologiska komplex såsom cytokrom P450 , NO-syntas och isopenicillin-N-syntas. Två sådana rapporterade föreningar är tiolatligerad oxojärn(IV) och cyklamacetat-oxojärn(IV). Tiolatligerad oxojärn(IV) bildas genom oxidation av en prekursor, [Fe II (TMCS)](PF 6 ) (TMCS = 1-merkaptoetyl-4,8,11-trimetyl-1,4,8,11- tetrazacyklotetradekan), och 3-5 ekvivalenter H2O2 vid -60 ˚C i metanol . Järn(IV)-föreningen är djupblå till färgen och visar intensiva absorptionsegenskaper vid 460 nm, 570 nm, 850 nm och 1050 nm. Denna art Fe IV (=O)(TMCS)+ är stabil vid -60 ˚C, men nedbrytning rapporteras när temperaturen ökar. Förening 2 identifierades med Mössbauer-spektroskopi , högupplöst elektrosprayjoniseringsmasspektrometri (ESI-MS), röntgenabsorptionsspektroskopi , utökad röntgenabsorptionsfinstruktur (EXAFS), ultraviolett-synlig spektroskopi (UV-vis), Fourier-transform infraröd spektroskopi (FT-IR), och resultaten jämfördes med beräkningar av densitetsfunktionella teorin (DFT).
Tetrametylcyklamoxojärn (IV) bildas genom reaktionen av Fe II (TMC)(OTf) 2 , TMC = 1,4,8,11-tetrametyl-1,4,8,11-tetraazacyklotetradekan; OTf = CF3SO3 , med jodosylbensen (PhIO) i CH3CN vid -40 ˚C . En andra metod för bildning av cyklamoxojärn(IV) rapporteras som reaktionen av Fe II (TMC)(OTf) 2 med 3 ekvivalenter H2O2 under 3 timmar . Denna art är ljusgrön till färgen och har ett absorptionsmaximum vid 820 nm. Det rapporteras vara stabilt i minst 1 månad vid -40 ˚C. Det har karakteriserats av Mössbauer-spektroskopi, ESI-MS, EXAFS, UV-vis, Raman-spektroskopi och FT-IR.
Högvärdiga järnbispidinkomplex kan oxidera cyklohexan till cyklohexanol och cyklohexanon i 35 % utbyte med ett alkohol till ketonförhållande upp till 4.
Fe(V)O
Fe V TAML(=O), TAML = tetra-amido makrocyklisk ligand , bildas genom reaktion av [Fe III (TAML)(H 2 O)](PPh 4 ) med 2-5 ekvivalenter meta-klorperbensoesyra vid - 60 ˚C i n-butyronitril. Denna djupgröna förening (två λ max vid 445 respektive 630 nm) är stabil vid 77 K. Stabiliseringen av Fe(V) tillskrivs den starka π–donatorkapaciteten hos deprotonerade amidkväve.
Fe(VI)O
Ferrat(VI) är en oorganisk anjon med kemisk formel [FeO 4 ] 2− . Det är ljuskänsligt och bidrar med en blekviolett färg till dess föreningar och lösningar. Det är en av de starkaste vattenstabila oxiderande arterna som är kända. Även om det klassificeras som en svag bas , är koncentrerade lösningar av ferrat(VI) endast stabila vid högt pH .
Elektronisk struktur
Den elektroniska strukturen av porfyrinoxojärnföreningar har granskats.
Nitridojärn och imidojärnföreningar
Nitridoiron och imidoiron föreningar är nära besläktade med järn-kväve kemi . Den biologiska betydelsen av nitridoiron(V) -porfyriner har granskats. En allmänt användbar metod för att generera högvalenta nitridojärnarter är termisk eller fotokemisk oxidativ eliminering av molekylärt kväve från ett azidkomplex .
- symbolisk oxidativ eliminering av kväve ger ett nitridojärnkomplex; L betecknar den bärande liganden.
Fe(IV)N
Det finns flera strukturellt karakteriserade nitridoiron(IV)-föreningar.
Fe(V)N
Den första nitridoiron(V)-föreningen syntetiserades och karakteriserades av Wagner och Nakamoto (1988, 1989) med hjälp av fotolys och Raman-spektroskopi vid låga temperaturer.
Fe(VI)N
En andra Fe VI -art förutom ferrat(VI) -jonen, [( Me3cy -ac)FeN](PF6 ) 2 , har rapporterats. Denna art bildas genom oxidation följt av fotolys för att ge Fe(VI)-arten. Karakterisering av Fe(VI)-komplexet gjordes av Mossbauer, EXAFS, IR och DFT-beräkningar. Till skillnad från ferrat(VI)-jonen är förening 5 diamagnetisk .
μ-Nitridföreningar och oxidationskatalys
Bryggade μ-nitrido-di- järnftalocyaninföreningar som järn(II)ftalocyanin katalyserar oxidationen av metan till metanol , formaldehyd och myrsyra med väteperoxid som offeroxidant.
Elektronisk struktur
Nitridoiron(IV) och nitridoiron(V)-arter undersöktes först teoretiskt 2002.
Se även
- Jacobsens katalysator (högvärdig mangan)
- Järn(IV)oxytetrafluorborat
Vidare läsning
- Solomon et al.; Angewandte Chemie International Edition Volym 47, Issue 47, sid 9071–9074, 10 november 2008; doi : 10.1002/anie.200803740