Babler oxidation
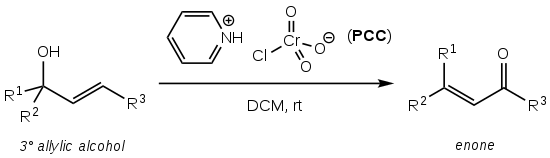
Babler -oxidationen , även känd som Babler-Dauben-oxidationen , är en organisk reaktion för oxidativ omvandling av tertiära allylalkoholer till enoner med pyridiniumklorkromat (PCC) :
Det är uppkallat efter James Babler som först rapporterade reaktionen 1976 och William Dauben som utökade omfattningen till cykliska system 1977, vilket avsevärt ökade den syntetiska användbarheten:
Reaktionen ger den önskade enonprodukten till högt utbyte (typiskt >75%), är operativt enkel och kräver inte luftfria tekniker eller uppvärmning. Det lider dock av den mycket höga toxicitet och miljöfara som det hexavalenta krom PCC-oxiderande reagenset utgör.
Det valda lösningsmedlet är vanligtvis torr diklormetan (DCM) eller kloroform (CHCl3 ) .
Reaktionen har använts som ett steg i den totala syntesen av olika föreningar, t.ex. av morfin .
Mekanism
Reaktionen fortskrider genom bildning av en kromatester ( 1 ) från nukleofil attack av klorokromatet av allylalkoholen. Estern genomgår sedan ett [3,3]-sigmatropiskt skifte för att skapa den isomera kromatestern ( 2 ). Slutligen ger oxidation av denna mellanprodukt den α,β-omättade aldehyd- eller ketonprodukten ( 3 ).
Alternativa reagenser
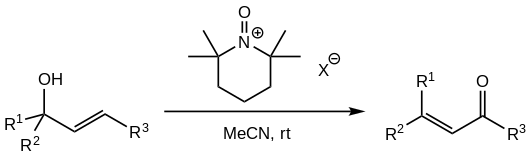
Oro för PCC-oxidantens höga toxicitet och cancerogenicitet , liksom krom(VI)-arternas roll som miljöföroreningar i grundvattnet, har lett till undersökningar för att ersätta PCC i reaktionen. Ett framgångsrikt alternativ som rapporterats av flera källor involverar användningen av N - oxoammoniumsalter härledda från TMP :
Oxoammoniumsalterna med icke-koordinerande anjoner används (såsom tetrafluorborat , perklorat , hexafluorfosfat eller hexafluorantimonat ). Oxidationsmedlet tillsätts i stökiometriska mängder, vanligtvis 1,5 ekv alkohol.
Ett annat tillvägagångssätt för att minimera giftigt krom(VI)-användning innebär att man utför reaktionen med endast en katalytisk mängd PCC och ett överskott av en annan oxidant, för att återoxidera kromarten som en del av den katalytiska cykeln . Vanligt rapporterade stökiometriska reagens för detta ändamål inkluderar di- tert -butylperoxid , 2-jodoxibensoesyra eller perjodater .
Sekundära alkoholer
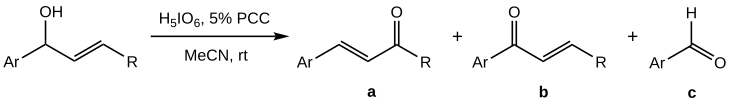
Babler-Dauben-oxidationen av sekundära allylalkoholer visar sig vara svårare att kontrollera än den för tertiära analoger, eftersom tillsammans med den önskade produkten (a) en blandning med hög andel biprodukter ( b ) och ( c ) erhålls:
Utbytet av a visar sig vara maximerat när PCC inte används i stökiometriska mängder utan som en samoxidant; den bästa effekten (50–70 % utbyte av a ) uppnås för ortoperiodsyra som huvudoxidationsmedel med en 5 % molär PCC. Acetonitril (MeCN) över den vanliga DCM används som lösningsmedel.
I motsats till den allmänna oxidationen av tertiära alkoholer, fungerar det sekundära alkoholfallet endast med aromatiska substrat (Ar-: en arylgrupp ). Detta, tillsammans med de starkt sura förhållandena på grund av den stökiometriska mängden perjodsyra, tyder på att den initialt bildade kromatestern isomeriserar genom en karbokatjonisk väg snarare än en sigmatotropisk reaktion som för tertiära alkoholer.