Hypoglycin A

|
|
| Namn | |
|---|---|
|
Föredraget IUPAC-namn
(2S ) -2-amino-3-[( IR )-2-metylidencyklopropyl]propansyra |
|
| Andra namn Hypoglycin A; Hypoglycin; 2-metylencyklopropanylalanin
|
|
| Identifierare | |
|
3D-modell ( JSmol )
|
|
| ChEMBL | |
| ChemSpider | |
| ECHA InfoCard | 100.189.936 |
|
PubChem CID
|
|
| UNII | |
|
CompTox Dashboard ( EPA )
|
|
|
|
|
|
| Egenskaper | |
| C7H11NO2 _ _ _ _ _ _ | |
| Molar massa | 141,170 g·mol -1 |
| Smältpunkt | 282 °C (540 °F; 555 K) |
|
Om inte annat anges ges data för material i standardtillstånd (vid 25 °C [77 °F], 100 kPa).
|
|
Hypoglycin A är ett naturligt förekommande aminosyraderivat som finns i den omogna frukten av Ackee -trädet ( Blighia sapida ) och i fröna från boxfläderträdet ( Acer negundo ). Det är giftigt vid förtäring och är orsaken till jamaicansk kräkningssjuka . En Lancet-rapport från 2017 etablerade ett samband mellan konsumtion av omogna litchi (innehållande hypoglycin A eller metylencyklopropylglycin (MCPG)) som resulterade i hypoglykemi och dödsfall från akut toxisk encefalopati.
Källor
Hela den omogna Ackee-frukten är giftig och innehåller stora mängder hypoglycin. Frukten är säker att äta endast när frukten tillåts öppna sig helt och exponera de stora svarta fröna medan de är på trädet. Nivåerna av toxinet minskar med tiden dock från cirka 1000 ppm till cirka 0,1 ppm i den mogna frukten.
Släktingar till Ackee, inklusive litchi , longan och rambutan , kan innehålla tillräckligt med α-(metylencyklopropyl)glycin, en homolog till hypoglycin A, i sin frukt för att orsaka hypoglykemisk encefalopati hos undernärda barn, när de konsumeras i stora mängder.
Giftighet
Hypoglycin A är ett protoxin , vilket betyder att molekylen inte är giftig i sig utan bryts ner till giftiga produkter vid intag. Det grenade alfa-ketosyradehydrogenaskomplexet , som normalt omvandlar leucin , isoleucin eller valin till acyl-CoA- derivat, omvandlar Hypoglycin A till mycket giftigt MCPA - CoA . FAD - kofaktorn som är nödvändig för betaoxidationen av fettsyror associeras med alfakolet i MCPA-CoA och skapar ett irreversibelt komplex som inaktiverar enzymet. Dessutom blockerar MCPA-CoA vissa enzymer som krävs för glukoneogenes .
Minskningen av glukoneogenes och minskningen av fettsyraoxidation tros vara orsaken till de flesta symtomen på jamaicansk kräkningssjuka. Blockeringen av fettsyrametabolismen gör att celler börjar använda glykogen som energi. När glykogenet är förbrukat kan kroppen inte producera mer, vilket leder till allvarlig hypoglykemi. Dessa biokemiska effekter upptäcks av ett överskott av medelkedjiga fettsyror i urin och acidos . Nyckelbehandlingar syftar till att kringgå eller motverka de biokemiska förändringarna, och inkluderar IV-vätskor och glukos , och hemodialys vid njursvikt .
Syntes
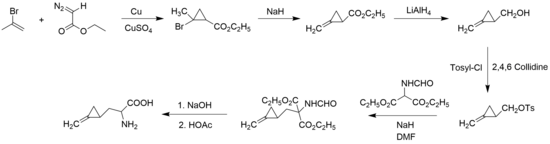
1958 var John Carbon, William Martin och Leo Swett de första att syntetisera hypoglycin A, i racemisk form, med utgångspunkt från 2-bromopropen och etyldiazoacetat för att bilda cyklopropanringen .
År 1992 åstadkom Jack Baldwin , Robert Adlington, David Bebbington och Andrew Russell den första asymmetriska totalsyntesen av de individuella diastereoisomererna av hypoglycin A, med användning av Sharpless epoxidation för att tillåta en asymmetrisk metylencyklopropansyntes. ' H NMR och cirkulär dikroism- studier identifierar den huvudsakliga diastereoisomeren av naturligt hypogycin A som (2S, 4R ) och den mindre diastereoisomeren som (2S, 4S ) .