Ceric ammoniumnitrat

|
|
| Namn | |
|---|---|
|
IUPAC-namn
Diammoniumcerium(IV)nitrat
|
|
| Andra namn Cerisk ammoniumnitrat CAN Diammoniumhexanitratocerat(IV) |
|
| Identifierare | |
|
3D-modell ( JSmol )
|
|
| ChemSpider | |
| ECHA InfoCard | 100.037.100 |
| EG-nummer |
|
|
PubChem CID
|
|
| UNII | |
|
CompTox Dashboard ( EPA )
|
|
|
|
|
|
| Egenskaper | |
| [NH4 ] 2 [ Ce( NO3 ) 6 ] | |
| Molar massa | 548,218 g·mol -1 |
| Utseende | orangeröda kristaller |
| Smältpunkt | 107 till 108 °C (225 till 226 °F; 380 till 381 K) |
|
141 g/100 ml (25 °C) 227 g/100 ml (80 °C) |
|
| Strukturera | |
| Monoklinisk | |
| Icosahedral | |
| Faror | |
| GHS- märkning : | |
 
|
|
| Fara | |
| H272 , H302 , H315 , H319 , H335 | |
| P220 , P261 , P305+P351+P338 | |
| Besläktade föreningar | |
|
Besläktade föreningar
|
Ammoniumnitrat Cerium(IV)oxid |
|
Om inte annat anges ges data för material i standardtillstånd (vid 25 °C [77 °F], 100 kPa).
|
|
Ceriumammoniumnitrat (CAN) är den oorganiska föreningen med formeln (NH 4 ) 2 [Ce(NO 3 ) 6 ] . Detta orangeröda, vattenlösliga ceriumsalt är ett specialiserat oxidationsmedel i organisk syntes och en standardoxidant i kvantitativ analys .
Förberedelse, egenskaper och struktur
Anjonen [Ce(NO 3 ) 6 ] 2− genereras genom att lösa Ce ) O 3 2 i varm och koncentrerad salpetersyra ( HNO 3 .
Saltet består av hexanitratocerat(IV)-anjonen [ Ce(NO 3 ) 6 ] 2− och ett par ammoniumkatjoner [NH 4 ] + . Ammoniumjonerna är inte involverade i oxidationsreaktionerna av detta salt. I anjonen kelerar varje nitratgrupp ceriumatomen på ett bidentat sätt som visas nedan:
Anjonen [Ce(NO 3 ) 6 ] 2− har Th ( idealiserad O h ) molekylär symmetri . CeO 12 - kärnan definierar en ikosaeder .
Ce 4+ är ett starkt enelektronoxidationsmedel . När det gäller dess redoxpotential (E° ~ 1,61 V vs. NHE) är det ännu starkare oxidationsmedel än Cl 2 (E° ~ 1,36 V). Få lagringsstabila reagenser är starkare oxidanter. I redoxprocessen omvandlas Ce(IV) till Ce(III), en enelektronförändring, som signaleras av blekningen av lösningsfärgen från orange till blekgul (förutsatt att substratet och produkten inte är starkt färgade).
Tillämpningar inom organisk kemi
I organisk syntes är CAN användbar som oxidant för många funktionella grupper ( alkoholer , fenoler och etrar ) såväl som CH-bindningar, särskilt de som är bensyliska. Alkener genomgår dinitroxylering, även om resultatet är lösningsmedelsberoende. Kinoner framställs av katekoler och hydrokinoner och även nitroalkaner oxideras.
CAN tillhandahåller ett alternativ till Nef-reaktionen ; till exempel för ketomakrolidsyntes där komplicerande sidoreaktioner vanligtvis uppstår med användning av andra reagens. Oxidativ halogenering kan främjas av CAN som en in situ- oxidant för bensylisk bromering och jodering av ketoner och uracilderivat .
För syntes av heterocykler
Katalytiska mängder av vattenhaltig CAN möjliggör effektiv syntes av kinoxalinderivat . Kinoxaliner är kända för sina tillämpningar som färgämnen, organiska halvledare och DNA-klyvningsmedel. Dessa derivat är också komponenter i antibiotika såsom echinomycin och actinomycin . Den CAN-katalyserade trekomponentreaktionen mellan aniliner och alkylvinyletrar ger ett effektivt inträde i 2-metyl-1,2,3,4-tetrahydrokinoliner och motsvarande kinoliner som erhålls genom deras aromatisering .
Som ett avskyddande reagens
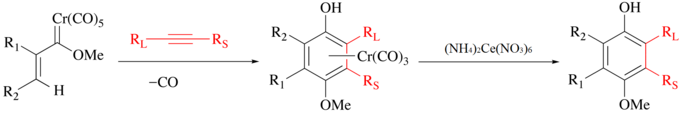
CAN används traditionellt för att frigöra organiska ligander från metallkarbonyler . I processen oxideras metallen, CO utvecklas och den organiska liganden frigörs för vidare manipulation. Till exempel, med Wulff-Dötz-reaktionen kombineras en alkyn, kolmonoxid och en kromkarben för att bilda ett kromhalvsandwichkomplex och fenolliganden kan isoleras genom mild CAN-oxidation.
CAN används för att klyva para -metoxibensyl- och 3,4-dimetoxibensyletrar, som är skyddsgrupper för alkoholer. Två ekvivalenter CAN krävs för varje ekvivalent para -metoxibensyleter. Alkoholen frigörs och para -metoxibensyletern omvandlas till para -metoxibensaldehyd. Den balanserade ekvationen är som följer:
- 2 [NH 4 ] 2 [Ce(NO 3 ) 6 ] + H 3 COC 6 H 4 CH 2 OR + H 2 O → 4 [NH 4 ] + + 2 Ce 3+ + 12 NO − 3 + 2 H + + H3COC6H4CHO + HOR _ _ _ _
Andra applikationer
CAN är också en komponent i krometsningsmedel , ett material som används vid tillverkning av fotomasker och flytande kristallskärmar . [ citat behövs ]