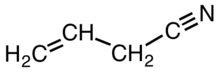
Allylcyanid
|
|

|
|
| Namn | |
|---|---|
|
Föredraget IUPAC-namn
But-3-enenitril |
|
| Identifierare | |
|
3D-modell ( JSmol )
|
|
| 605352 | |
| ChEBI | |
| ChemSpider | |
| ECHA InfoCard | 100.003.366 |
| EG-nummer |
|
|
PubChem CID
|
|
| UNII | |
|
CompTox Dashboard ( EPA )
|
|
|
|
|
|
| Egenskaper | |
| C4H5N _ _ _ _ | |
| Molar massa | 67,091 g·mol -1 |
| Utseende | färglös vätska |
| Densitet | 0,834 g/cm 3 |
| Smältpunkt | −87 °C (−125 °F; 186 K) |
| Kokpunkt | 116 till 121 °C (241 till 250 °F; 389 till 394 K) |
| Faror | |
| Arbetssäkerhet och hälsa (OHS/OSH): | |
|
Huvudsakliga faror
|
Brandfarligt, giftigt, irriterar hud och ögon |
|
Förtäringsrisker
|
Giftigt vid förtäring. |
|
Inandningsrisker
|
Kan vara dödligt vid inandning. Orsakar irritation i luftvägarna. |
|
Ögonfaror
|
Orsakar ögonirritation. |
|
Hudfaror
|
Orsakar hudirritation. |
| GHS- märkning : | |
 
|
|
| Fara | |
| H226 , H301 , H311 , H312 , H315 , H319 | |
| P261 , P280 , P301+P310 , P305+P351+P338 , P311 | |
| NFPA 704 (branddiamant) | |
| Flampunkt | 24 °C (75 °F; 297 K) |
| 455 °C (851 °F; 728 K) | |
| Säkerhetsdatablad (SDS) | MSDS |
|
Om inte annat anges ges data för material i standardtillstånd (vid 25 °C [77 °F], 100 kPa).
|
|
Allylcyanid är en organisk förening med formeln CH 2 CHCH 2 CN. Liksom andra små alkylnitriler är allylcyanid färglös och löslig i organiska lösningsmedel. Allylcyanid förekommer naturligt som ett anti-feedant och används som ett tvärbindningsmedel i vissa polymerer.
Syntes
Allylcyanid erhålls genom reaktion av allylacetat med vätecyanid.
En laboratorieväg till allylcyanid innefattar behandling av allylbromid med koppar(I)cyanid .
- CH2 =CHCH2Br + CuCN → CH2 = CHCH2CN + CuBr
Andra allylhalider kan användas för denna reaktion inklusive allyljodid som gjordes av A. Rinne och B. Tollens 1871 där jodid är en bättre lämnande grupp än dess bromidekvivalent och därför ökar utbytet.
Naturliga händelser
Allylcyanid upptäcktes 1863 av H. Will och W. Koerner 1863, de fann att föreningen fanns i senapsolja . Den första syntesen av allylcyanid rapporterades av A. Claus 1864.
Allylcyanid produceras i korsblommiga grönsaker av myrosinas , ett enzym som hydrolyserar glukosinolater för att bilda nitriler och andra produkter. Myrosinas aktiveras av l-askorbinsyra (vitamin C) under påverkan av pH, och högre myrosinasaktivitet har visats i skadade kålblad, medan dess aktivitet reduceras genom att koka bladen, även om glukosinolaterna sedan kan omvandlas till allyl cyanid av mikroflora i tarmarna. Eftersom korsblommiga grönsaker som kål, broccoli, blomkål och groddar är en del av människans kost, konsumeras allylcyanid normalt oralt. Den normala dosen av allylcyanid som ingår i en måltid har visat sig vara mycket lägre än de doser som används i djurstudier. Den dagliga nivån vid vilken beteendeeffekter påvisades är 500 μg/kg kroppsvikt, medan den dagliga mänskliga konsumtionen uppgår till 0,12 μg/kg. Även om dos-responssambandet fortfarande ska undersökas, anses det därför att allylcyanid inte har någon styrka som ett neurotoxiskt medel när det konsumeras i grönsaker.
Ansökningar
Allylcyanid kan användas som tillsats i propylenkarbonatbaserade elektrolyter för grafitanoder som förhindrar exfoliering av anoden genom filmbildning. Den underliggande mekanismen tros vara en reduktiv polymerisationsmekanism.
Neurotoxicitet
Studier utförda på råttor visade att allylcyanid orsakar förlust av hårceller i hörselsystemet och besvär av hornhinnan. Samma studie visade också att uppfödningsaktiviteten hos råttor minskade genom oralt intag av allylcyanid. Det har dessa neurotoxiska symtom gemensamt med andra alifatiska mononitriler såsom 2-butenenitril och 3,3'-iminopropionitril. Allylcyanid visade sig också orsaka en svullnad av axonerna. Studier gjorda med möss visade att en enda (om än ganska hög) dos av allylcyanid kan orsaka permanenta beteendeförändringar. Dessa förändringar inkluderar ryckningar i huvudet, ökad rörelseaktivitet och cirkulation. Dessa möss visades dessutom lida av neuronala sammandragningar, vilket möjligen ledde till celldöd. Får är mycket mer toleranta mot de toxiska effekterna av allylcyanid än råttor. Studier tyder på att denna avgiftning beror på försmältningen i vommen .
Toxikokinetik
Allylcyanid är känt för att metaboliseras i levern av enzymsystemet Cytokrom P-450 (främst CYP2E1) till cyanid. Absorptionen och distributionen av allylcyanid hos råttor är utomordentligt snabb. De högsta koncentrationerna av allylcyanid uppmättes i magvävnaden och maginnehållet på grund av det faktum att magen är det huvudsakliga absorptionsstället efter oral administrering. De näst högsta koncentrationsnivåerna visade sig vara i benmärgen med en topp i koncentrationen mellan 0 och 3 timmar efter administrering. Levern, njurarna, mjälten och lungorna ackumulerade också allylcyanid under loppet av 48 timmar. Den högsta koncentrationen i njuren observerades mellan 3 och 6 timmar efter dosering. Denna observation indikerar snabb eliminering av allylcyanid. Den huvudsakliga avgiftningsvägen är omvandlingen från cyanid till tiocyanat. De viktigaste utsöndringsvägarna är genom urinen och utandningsluften.
Serotonin- och dopaminsystemen tros vara involverade i de beteendeavvikelser som orsakas av allylcyanid. Behandling med serotonin- och dopaminantagonister orsakade en minskning av beteendeavvikelserna. Ataxi, darrningar, kramper, diarré, salivutsöndring, tårbildning och oregelbunden andning är kända effekter som orsakas av oralt intag av allylcyanid.
- ^ a b c d MSDS
- ^ a b Ludger Krähling; Jürgen Krey; Gerald Jakobson; Johann Grolig; Leopold Miksche (2002). "Allylföreningar". Ullmanns Encyclopedia of Industrial Chemistry . Weinheim: Wiley-VCH. doi : 10.1002/14356007.a01_425 .
- ^ JV Supniewski; PL Salzberg (1928). "Allylcyanid". Org. Synth . 8 : 4. doi : 10.15227/orgsyn.008.0004 .
- ^ A. Rinne, B. Tollens: "Ueber das Allylcyanür oder Crotonitril", i: Justus Liebigs Annalen der Chemie, 1871, 159 (1), S. 105–109; doi:10.1002/jlac.18711590110
- ^ C. Pomeranz: "Ueber Allylcyanid und Allylsenföl", i: Justus Liebigs Annalen der Chemie, 1906, 351 (1–3), S. 354–362: doi:10.1002/jlac.19073510127
- ^ A. Claus: "Ueber Crotonsäure", i: Justus Liebigs Annalen der Chemie, 1864, 131 (1), P. 58–66;doi:10.1002/jlac.18641310106
- ^ a b H. Tanii et al. Allylnitril: generering från korsblommiga grönsaker och beteendeeffekter på möss vid upprepad exponering / Food and Chemical Toxicology, 42, (2004), 453-458
- ^ LG West et al. Allylisotiocyanat- och allylcyanidproduktion i cellfria kålbladsextrakt, strimlad kål och Cole Slaw / J. Agric. Food Chem. Vol. 25, nr 6, (1997), 1234-1238
- ^ C. Krul et al. Metabolism av sinigrin (2-propenylglukosinolat) av den mänskliga kolonmikrofloran i en dynamisk in vitro tjocktarmsmodell / Carcinogenesis, Vol. 24, nr 6, (2002), 1009-1016
- ^ L. Zhang et al. Allylcyanid som en ny funktionell tillsats i propylenkarbonatbaserad elektrolyt för litiumjonbatterier Iconics Augusti 2013, Volym 19, Issue 8, pp 1099-1103
- ^ E. Balbuena, J. Llorens Beteendestörningar och sensorisk patologi efter allylnitrilexponering hos råttor / Brain Research 904 (2001) 298-306
- ^ C. Soler-Martín et al. Butenenitriler har låg axonopatisk potential hos råtta / Toxicology Letters 200 (2011) 187-193
- ^ Xiao-ping Zang et al. Beteendeavvikelser och apoptotiska förändringar i neuroner i möss hjärna efter en enda administrering av allylnitril / Arch Toxicol 73 (1999) 22-32
- ^ Duncan, AJ och Milne, JA (1992), Vom mikrobiell nedbrytning av allylcyanid som en möjlig förklaring till toleransen hos får mot brassica-härledda glukosinolater. J. Sci. Food Agric., 58: 15–19.
- ^ AE Ahmed och MYH Farooqui: Jämförande toxiciteter av alifatiska nitriler. Toxicol. Len. 12, 157-163 (1982)
- ^ E. Ahmed, MYH Farooqui och NM Tneff: Nitriler. I: "Biotransformation of Foreign Compounds" (MW Anders, red), s. 485-510. Academic Press, New York, 1985.
- ^ H. Tanii, Y. Kurosaka, M. Hayashi och K. Hashimoto: Allylnitril: en förening som inducerar långvarig dyskinesi hos möss efter en enda administrering. Exp. Neurol. 103, 64-67 (1989)
