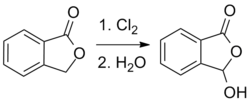2-karboxibensaldehyd
|
|
| Namn | |
|---|---|
|
Föredraget IUPAC-namn
2-formylbensoesyra |
|
| Andra namn 2-Ftaldehydsyra
|
|
| Identifierare | |
|
3D-modell ( JSmol )
|
|
| 742381 | |
| ChEBI | |
| ChEMBL | |
| ChemSpider | |
| ECHA InfoCard | 100.003.948 |
| EG-nummer |
|
|
PubChem CID
|
|
| UNII | |
|
CompTox Dashboard ( EPA )
|
|
|
|
|
|
| Egenskaper | |
| C8H6O3 _ _ _ _ _ | |
| löslig | |
| Löslighet | löslig i dietyleter , etanol |
|
Om inte annat anges ges data för material i standardtillstånd (vid 25 °C [77 °F], 100 kPa).
|
|
2-karboxibensaldehyd är en kemisk förening . Den består av en bensenring , med en aldehyd och en karboxylsyra som substituenter som är orto till varandra. Föreningen uppvisar ringkedjetautomerism : de två substituenterna kan reagera med varandra för att bilda 3-hydroxiftalid, en cyklisk laktol . Denna laktol reagerar lätt med Grignard-reagenser och bildar alkyl- och aryl- substituerade ftalider . Andra bensokondenserade heterocykliska föreningar kan härledas från 2-karboxibensaldehyd, inklusive isoindolinoner och ftalazinoner, med en mängd olika farmakologiska egenskaper, såsom antihistamin azelastin .
Syntes
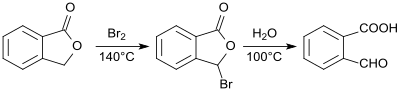
2-karboxibensaldehyd framställdes först av ftalid och karakteriserades 1887. Reaktionen av brom med ftalid ger 2-bromftalid, som omvandlas till 2-formylbensoesyra genom upphettning med vatten i ett totalt utbyte av 78 till 83%.
En analog process baserad på en kloreringsreaktion kan också användas:
Syntesen av 1-diklormetyl-2-(triklormetyl)bensen genom fotoklorering av o -xylen rapporterades också 1887.
Hydrolysen av pentakloroxylenen till 2-karboxibensaldehyden utförs genom att koka den med FeCl3- innehållande saltsyra.
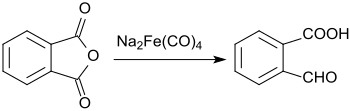
Vid reaktionen av ftalsyraanhydrid med natriumtetrakarbonylferrat reduceras endast en av karboxylgrupperna till aldehyden, den andra förblir oförändrad.
Detta ger 2-karboxibensaldehyd i ett utbyte av 61%.
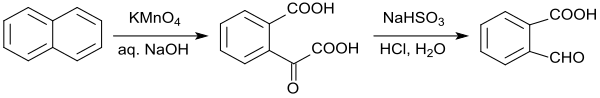
ges oxidation av naftalen med alkaliskt kaliumpermanganat , vilket dock endast ger ett utbyte av 39 % 2-karboxibensaldehyd. Oxidationen av naftalen med ozon till 2-formylbensoesyra ger inte heller några betydande fördelar.
Egenskaper
Ren 2-karboxibensaldehyd är ett vitt kristallint pulver som löses i vatten och i kortkedjiga alkoholer . I fast form och i de flesta lösningsmedel finns ämnet som racemisk 3-hydroxiftalid (en laktol) som ett resultat av ringkedjetautomerism.
Brytningsindex är = 1,4500 (vid 25 °C, 589 nm).
Ansökan
I laktolformen beter sig 2-karboxibensaldehyd som en karboxylsyraanhydrid och reagerar smidigt med alkoholer som bildar 3-alkoxiftalider.
Även med andra nukleofila föreningar, såsom tioler , aminer , amider , etc., reagerar 3-hydroxiftalid utan katalysator för att ge motsvarande derivat. Till exempel reagerar den med morfolin i 91 % utbyte till 3-morfolinylftalid. 3-hydroxiftalid reagerar med tionylklorid vid hydroxylgruppen jämnt (80-90 % utbyte) till 3-klorftalid. Med Grignard-reagenser kan hydroxigruppen bytas ut mot motsvarande alkyl- eller arylgrupp:
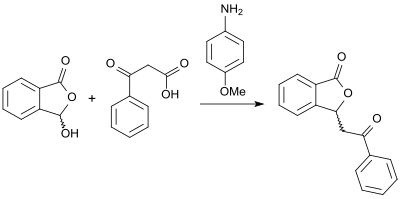
I närvaro av (+)- cinchonin , i reaktionen av (racemisk) 3-hydroxiftalid med karboxylsyraanhydrider till motsvarande kirala 3-substituerade ftalider kan ett enantiomert överskott på upp till 90% ee uppnås förutom höga produktutbyten. Ett alternativt tillvägagångssätt till (racemiska) 3-substituerade ftalider med höga utbyten öppnas upp genom reaktionen av 2-karboxibensaldehyd och β-ketosyror i närvaro av bas 4-anisidin i glycerol som lösningsmedel .
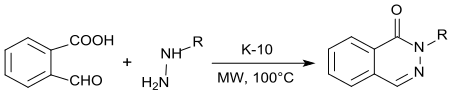
2-karboxibensaldehyd undergår en dubbel kondensationsreaktion med hydrazin eller alkylhydraziner, 1(2H ) -ftalenazinoner erhålls under sur katalys med K10- montmorillonit och mikrovågsbestrålning i högt utbyte.
Ftalazinoner (1(2H ) -ftalenazinoner) är viktiga byggstenar för naturprodukter , finkemikalier och farmaceutiskt aktiva ingredienser, såsom den blodtryckssänkande vasodilatorn hydralazin .
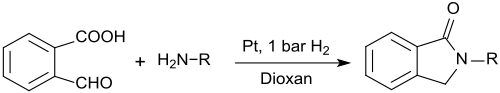
2-karboxibensaldehyd kan också användas för framställning av N-substituerade isoindolinoner (1-isoindolinoner, 2,3-dihydroindol-1-oner) som bildas vid reaktion av 2-karboxibensaldehyd med primära aminer i närvaro av platinananotrådar och lågvätehalt tryck i 1,4-dioxan i mycket höga utbyten:
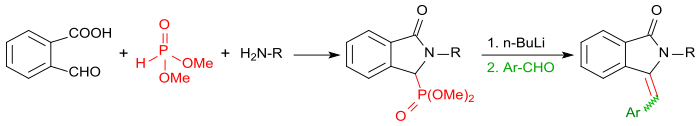
När reaktionen av 2-karboxibensaldehyd utförs med primära aminer i närvaro av dimetylfosfit , erhålls först motsvarande isoindolin-1-on-3-fosfonater. Efter aktivering med butyllitium med aromatiska aldehyder (såsom bensaldehyd i en Horner-Wadsworth-Emmons-reaktion ) kan dessa omvandlas i mycket höga utbyten till 3-(arylmetylen)isoindolin-1-oner.
På senare tid blev 2-formylbensoesyra på grund av dess reaktivitet av visst intresse som mångsidig molekylär byggsten i flerkomponentreaktioner , till exempel Ugi-reaktionen , för syntes av heterocykliska annelerade aromater. Funktionaliserade isoindolinoner är tillgängliga i högt utbyte i en trekomponentsreaktion med 2-formylbensoesyra och 2-bromaniliner genom palladiumkatalyserad karbonylering .
En annan trekomponentreaktion (här utförd som Strecker-syntes ) med 2-karboxibensaldehyd, primära aminer och kaliumcyanid i metanol ger i det sura mediet en N-substituerad isoindolinon-1-karbonitril, formellt ett aminoacetonitrilderivat av isoindolinon med två av HCN.
När substituerad 2-formylbensoesyra, kaliumcyanid och ekvimolära mängder av primära aromatiska aminer och ättiksyra används, erhålls substituerade isokromer-1-oner ( isokumariner , 1H-2-bensopyran-1-oner) i goda utbyten.
De erhållna isokromonerna omvandlas kvantitativt till isoindolinoner genom att reagera i DMSO vid ringförträngning till substituerade isobensofuraner eller med katalytiska mängder jod i trietylamin.
Med isonitriler istället för kaliumcyanid, reagerar 2-karboxibensaldehyd och primära aromatiska aminer i metanol och bildar substituerade isokromen-1-oner, som omvandlas till isoindolinoner med spår av syra.
Syntesvägar för isokinolinderivatet kinisokain (fungerar som ett lokalbedövningsmedel) och antihistamin azelastin är också baserade på 2-karboxibensaldehyd som utgångsmaterial.
- ^ a b William M. Haynes (2016), CRC Handbook of Chemistry and Physics, 97:e upplagan , Boca Raton, FL, USA: CRC Press, s. 3–278, ISBN 978-1-4987-5429-3
- ^ a b P. Cannone; J. Plamondon; M. Akssira (1988), "Reactions selectives de organomagnesiens avec les lactols et les lactones. Synthese des diols primaires-secondaires", Tetrahedron , vol. 44, nr. 10, s. 2903–2912, doi : 10.1016/S0040-4020(88)90027-0
- ^ S. Racine (1887), "VIII. Ueber Phthalaldehydsäure" , Justus Liebigs Ann. Chem. (på tyska), vol. 239, nr. 1, s. 78–91, doi : 10.1002/jlac.18872390106
- ^ "Ftalaldehydsyra", Organic Syntheses , doi : 10.15227/orgsyn.023.0074
- ^ a b J. Druey; BH Ringier (1951), "21. Hydrazinderivate der Phthalazin- und Pyridazinreihe", Helv. Chim. Acta (på tyska), 34 (1): 195–210, doi : 10.1002/hlca.19510340122
- ^ A. Colson; H. Gautier (1887), "Nouveau mode de chloruration des carbures", Ann. Chim. Phys. vol. 6, nr. 11, s. 19–32
- ^ a b c d D.D. Wheeler; DC Young; DS Erley (1957), "Reactions of phthalaldehydic acid", J. Org. Chem. vol. 22, nr. 5, s. 547–556, doi : 10.1021/jo01356a022
- ^ Y. Watanabe; M. Yamashita; Ta. Mitsudo; M. Tanaka; Y. Takegami (1973), "Den lättsamma syntesen av aldehyder och aldehydsyror från karboxylsyraanhydrider med användning av natriumtetrakarbonylferrat", Tetrahedron Lett. vol. 14, nr. 37, s. 3535–3536, doi : 10.1016/S0040-4039(01)86963-X
- ^ "Ftalaldehydsyra", Organic Syntheses , doi : 10.15227/orgsyn.016.0068
- ^ L. Seekles (1924), "Ortho phthalaldehydic acid", Rec. Trav. Chim. vol. 43, nr. 5, s. 329–340, doi : 10.1002/recl.19240430506
- ^ Carl L. Yaws (2015), Thermophysical Properties of Chemicals and Hydrocarbons, 2nd Edition , Oxford, UK: Elsevier Inc., s. 183, ISBN 978-0-323-28659-6
- ^ a b K.B. Sloan; SAM Koch (1983), "Effect of Nucleophilicity and Leaving Group Ability på SN2- reaktionerna av aminer med (Acyloxi)alkyl-a-halider: A Product Distribution Study", J. Org. Chem. vol. 48, nr. 5, s. 635–640, doi : 10.1021/jo00153a002
- ^ D. Niedek; SMM Schuler; C. Eschmann; RC Wende; A. Seitz; F. Keul; PR Schreiner (2017), "Syntes av enantioberikade ftalider och isoindolinonderivat från 2-formylbensoesyra", Synthesis , vol. 49, nr. 2, s. 371–382, doi : 10.1055/s-0036-1589404
- ^ L. Jia; F. Han (2017), "Hållbar syntes av 3-substituerade ftalider via en katalytisk one-pot kaskadstrategi från 2-formylbensoesyra med β-ketosyror i glycerol", Beilstein J. Org . Chem. vol. 13, s. 1425–1429, doi : 10.3762/bjoc.13.139 , PMC 5530723 , PMID 28781708
- ^ VM Outerbridge; SM Landge; H. Tamaki; B. Török (2009), "Microwave-promoted solid-acid-catalyzed one-pot synthesis of phthalazinones", Synthesis , vol. 2009, nej. 11, s. 1801–1806, doi : 10.1055/s-0028-1088074
- ^ a b L. Shi; L. Hu; J. Wang; X. Cao; H. Gu (2012), "Mycket effektiv syntes av N-substituerade isoindolinoner och ftalazinoner med Pt nanotrådar som katalysatorer", Org. Lett. vol. 14, nr. 7, s. 1876–1879, doi : 10.1021/ol300471a , PMID 22420427
- ^ MA Reyes-Gonzàlez; A. Zamundio-Medina; M. Ordónez (2012), "Praktisk och mycket selektiv syntes av 3-(arylmetylen)isoindolin-1-oner från 2-formylbensoesyra", Tetrahedron Lett. vol. 53, nr. 43, s. 5756–5758, doi : 10.1016/j.tetlet.2012.08.040
- ^ K. Natte; J. Chen; H. Li; H. Neumann; M. Beller; XF Wu (2014), "Palladiumkatalyserad karbonylering av 2-bromaniliner med 2-formylbensoesyra och 2-halobensaldehyder: Effektiv syntes av funktionaliserade isoindolinoner", Chem. Eur. J. , vol. 20, nej. 44, s. 14184–14188, doi : 10.1002/chem.201404446 , PMID 25212125
- ^ T. Opatz; D. Ferenc (2004), "En oväntad trekomponentskondensation som leder till amino-(3-oxo-2,3-dihydro-1 H -isoindol-1-yliden)-acetonitriles", J. Org. Chem. vol. 69, nr. 24, s. 8496–8499, doi : 10.1021/jo0486802 , PMID 15549828
- ^ T. Opatz; D. Ferenc (2005), "Enkel framställning av 3-amino-4-(arylamino)-1 H -isokromen-1-oner genom en ny flerkomponentreaktion", Eur. J. Org. Chem. vol. 2005, nr. 5, s. 817–821, doi : 10.1002/ejoc.200400685
- ^ T. Opatz; D. Ferenc (2006), "Ringkontrakterande omarrangemang av 3-amino-4-(arylamino)-1 H -isochromen-1-ones", Eur. J. Org. Chem. vol. 1, s. 121–126, doi : 10.1002/ejoc.200500575
- ^ C. Faggi; M. Garcia-Valverde; S. Macaccini; G. Menchi (2010), "Isolering av Ugi fyra-komponent kondensation primära addukter: En enkel väg till isokoumariner", Org. Lett. vol. 12, nr. 4, s. 788–791, doi : 10.1021/ol9028622 , PMID 20104888
- ^ JW Wilson; ND Dawson; W. Brooks; GE Ullyot (1949), "Local anesthetics. Aminoalkoxiisoquinolin derivatives", J. Am. Chem. Soc. vol. 71, nr. 3, s. 937–938, doi : 10.1021/ja01171a047 , PMID 18129083
- ^ F. v. Bruchhausen; et al., red. (1994), Hagers Handbuch der Pharmazeutischen Praxis, 5. Aufl. (på tyska), Berlin: Springer, sid. 482, doi : 10.1007/978-3-642-57880-9 , ISBN 978-3-642-63389-8
- ^ G. Scheffler; J. Engel; B. Kutscher; WS Sheldrick; P. Bell (1988), "Synthese und Kristallstrukturanalyse von Azelastin", Arch. Pharm. (på tyska), vol. 321, nr. 4, s. 205–208, doi : 10.1002/ardp.19883210406 , S2CID 96004319