Treonin ammoniak-lyas
| L -treonin ammoniak-lyas | |||||||||
|---|---|---|---|---|---|---|---|---|---|
 En 3d-tecknad skildring av treonindeaminas-
| |||||||||
| tetrameridentifierare | |||||||||
| EG nr. | 4.3.1.19 | ||||||||
| Databaser | |||||||||
| IntEnz | IntEnz-vy | ||||||||
| BRENDA | BRENDA inträde | ||||||||
| ExPASy | NiceZyme-vy | ||||||||
| KEGG | KEGG inträde | ||||||||
| MetaCyc | Metabolisk väg | ||||||||
| PRIAM | profil | ||||||||
| PDB- strukturer | RCSB PDB PDBe PDB summa | ||||||||
| Genontologi | AmiGO / QuickGO | ||||||||
| |||||||||
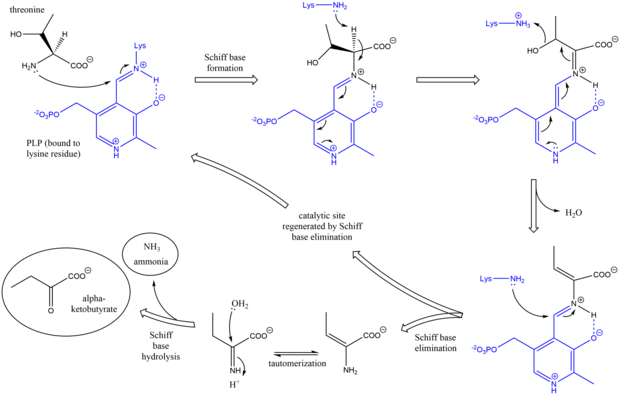
Treonin-ammoniak-lyas (EC 4.3.1.19, systematiskt namn L -treonin-ammoniak-lyas (2-oxobutanoat-bildande), även vanligen kallad treonindeaminas eller treonindehydratas , är ett enzym som ansvarar för att katalysera omvandlingen av L - treonin till α-ketobutyrat och ammoniak :
-
L -treonin = 2-oxobutanoat + NH 3 (total reaktion)
- (1a) L -treonin = 2-aminobut-2-enoat + H 2 O
- (1b) 2-aminobut-2-enoat = 2-iminobutanoat (spontant)
- ( 1c) 2-iminobutanoat + H2O = 2-oxobutanoat + NH3 (spontant)
α-Ketobutyrat kan omvandlas till L - isoleucin , så treonin ammoniak-lyas fungerar som ett nyckelenzym i BCAA -syntes . Den använder en pyridoxal-5'-fosfatkofaktor , liknande många enzymer som är involverade i aminosyrametabolism . Det finns i bakterier , jäst och växter , även om den mesta forskningen hittills har fokuserat på former av enzymet i bakterier. Detta enzym var ett av de första där negativ återkopplingsinhibering av slutprodukten av en metabolisk väg direkt observerades och studerades. Enzymet fungerar som ett utmärkt exempel på de reglerande strategier som används vid aminosyrahomeostas .
Strukturera
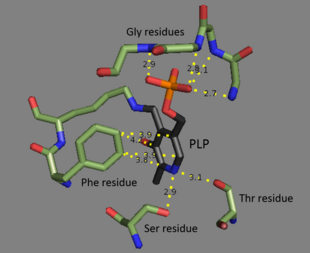
Treonin ammoniak-lyas är en tetramer av identiska subenheter och är arrangerad som en dimer av dimerer. Varje subenhet har två domäner : en domän som innehåller det katalytiskt aktiva stället och en domän med allosteriska regulatoriska platser. De två har visats vara distinkta regioner, men det regulatoriska stället för en subenhet interagerar faktiskt med det katalytiska stället för en annan subenhet. Båda domänerna innehåller det återkommande strukturella motivet av betaark omgivna av alfaspiraler . Även om treoninbindningsstället inte är perfekt förstått, visar strukturella studier hur pyridoxalfosfatkofaktorn är bunden. PLP-kofaktorn är bunden till en lysinrest med hjälp av en Schiff-bas , och fosfatgruppen i PLP hålls på plats av amingrupper härledda från en upprepad sekvens av glycinrester . Den aromatiska ringen är bunden till fenylalanin , och kvävet på ringen är vätebundet till hydroxylgruppinnehållande rester.
Mekanism
Mekanismen för treonin ammoniak-lyas är analog med andra deaminerande PLP-enzymer i dess användning av Schiff- basintermediärer . Inledningsvis attackerar amingruppen av treonin lysin/PLP Schiff-basen och ersätter lysin. Efter deprotonering av aminosyran alfa-kol och efterföljande dehydrering (därav det vanliga namnet treonindehydratas ) bildas en ny Schiff-bas. Denna Schiff-bas ersätts av lysinattack, vilket reformerar den katalytiskt aktiva PLP och frigör en initial alken- innehållande produkt. Denna produkt tautomeriserar , och efter hydrolys av Schiff-basen genereras slutprodukterna. Efter att den slutliga alfa-ketobutyratprodukten har genererats, syntetiseras isoleucin genom att gå genom mellanprodukterna alfa-acetohydroxibutyrat till alfa-beta-dihydroxi-beta-metylvalerat, sedan till alfa-keto-beta-metylvalerat.
förordning
Treonin ammoniak-lyas har visat sig inte följa Michaelis-Menten kinetiken , snarare är det föremål för komplex allosterisk kontroll. Enzymet hämmas av isoleucin, produkten av den väg det deltar i, och aktiveras av valin , produkten av en parallell väg. Således stänger en ökning av isoleucinkoncentrationen dess produktion, och en ökning i valinkoncentration leder bort utgångsmaterialet (Hydroxyethyl- TPP ) från valinproduktionen. Enzymet har två bindningsställen för isoleucin; en har hög affinitet för isoleucin och den andra har låg affinitet. Bindningen av isoleucin till högaffinitetsstället ökar bindningsaffiniteten för lågaffinitetsstället, och enzymdeaktivering inträffar när isoleucin binder till lågaffinitetsstället. Valin främjar enzymaktivitet genom att konkurrerande binda till högaffinitetsstället, vilket förhindrar isoleucin från att ha en hämmande effekt. Kombinationen av dessa två återkopplingsmetoder balanserar koncentrationen av BCAA.
Isoformer och andra funktioner
Flera former av treonin ammoniak-lyas har observerats i en mängd olika arter av organismer. I Escherichia coli , ett system där enzymet har studerats mycket, finns två olika former av enzymet. Den ena är biosyntetisk och liknar enzymegenskaperna som presenteras här, medan den andra är nedbrytande och fungerar för att generera kolfragment för energiproduktion . Paret av isoformer har också observerats i andra bakterier. I många bakterier uttrycks den biologiskt nedbrytande isoformen av enzymet under anaeroba förhållanden och främjas av cAMP och treonin, medan den biosyntetiska isoformen uttrycks under aeroba förhållanden. Detta gör att bakterien kan balansera energidepåer och hämma energikrävande syntetiska vägar när energin inte är riklig.
I växter är treonin ammoniak-lyas viktigt i försvarsmekanismer mot växtätare och uppregleras som svar på abiotisk stress . En anpassad isoform av enzymet med unika egenskaper som avskräcker växtätare uttrycks i växtblad. Den katalytiska domänen av denna isoform är extremt motståndskraftig mot proteolys , medan den regulatoriska domänen bryts ned lätt, så vid intag av en annan organism försvinner enzymets treonindeamineringsförmåga. Detta bryter ner treonin innan växtätaren kan absorbera det, vilket svälter växtätaren på en essentiell aminosyra . Studier av treonin ammoniak-lyas i växter har också erbjudit nya strategier för utveckling av GMO med ökat näringsvärde genom att öka innehållet av essentiella aminosyror.
Andra mer exotiska former av enzymet har hittats som är extremt små i storlek, men som fortfarande behåller alla katalytiska och reglerande funktioner.
Evolution
Det finns fem huvudtyper för PLP-beroende enzymer. Treonin ammoniak-lyas är en medlem av Fold Type II-familjen, även känd som tryptofansyntasfamiljen . Även om treonin-ammoniak-lyas inte har substrattunnling som tryptofansyntas, innehåller det mycket konserverad homologi . Treonin ammoniak-lyas är närmast besläktat med serindehydratas , och båda har samma allmänna katalytiska mekanism. I själva verket har treonin ammoniak-lyas visat sig uppvisa viss specificitet mot serin och kan omvandla serin till pyruvat . Den regulatoriska domänen av treonin ammoniak-lyas är mycket lik den regulatoriska domänen av fosfoglycerat dehydrogenas . Alla dessa samband visar att treonin ammoniak-lyas har nära evolutionära band till dessa enzymer. På grund av graden av konserverad struktur och sekvens i enzymer som känner igen aminosyror, är det troligt att den evolutionära mångfalden av dessa enzymer uppstod genom att individuella regulatoriska och katalytiska domäner matchades ihop på olika sätt.
Relevans för människor
Treonin ammoniak-lyas finns inte hos människor. Detta är alltså ett exempel på varför människor inte kan syntetisera alla 20 proteinogena aminosyrorna ; i detta specifika fall kan människor inte omvandla treonin till isoleucin och måste konsumera isoleucin i kosten. Enzymet har även tidigare studerats som ett möjligt tumörhämmande medel av de tidigare beskrivna skälen, genom att det berövar tumörcellerna en essentiell aminosyra och dödar dem, men denna behandling har inte använts.