Sulfitoxidas
| sulfitoxidas | |||||||||
|---|---|---|---|---|---|---|---|---|---|
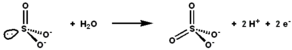 Sulfitoxidas katalyserar oxidations-reduktionsreaktionen av sulfit och vatten, vilket ger sulfat.
| |||||||||
| Identifierare | |||||||||
| EG nr. | 1.8.3.1 | ||||||||
| CAS-nr. | 9029-38-3 | ||||||||
| Databaser | |||||||||
| IntEnz | IntEnz-vy | ||||||||
| BRENDA | BRENDA inträde | ||||||||
| ExPASy | NiceZyme-vy | ||||||||
| KEGG | KEGG inträde | ||||||||
| MetaCyc | Metabolisk väg | ||||||||
| PRIAM | profil | ||||||||
| PDB- strukturer | RCSB PDB PDBe PDB summa | ||||||||
| Genontologi | AmiGO / QuickGO | ||||||||
| |||||||||
| SUOX | |||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | |||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||
| Identifierare | |||||||||||||||||||||||||||||||||||||||||||||||
| , entrez:6821, sulfitoxidas | |||||||||||||||||||||||||||||||||||||||||||||||
| Externa ID:n | |||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||
| Wikidata | |||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||
Sulfitoxidas ( EC 1.8.3.1 ) är ett enzym i mitokondrierna hos alla eukaryoter , med undantag av jästsvamparna. möjliggör Det oxiderar sulfit till sulfat och, via cytokrom c , överför de producerade elektronerna till elektrontransportkedjan , vilket generering av ATP i oxidativ fosforylering . Detta är det sista steget i metabolismen av svavelhaltiga föreningar och sulfatet utsöndras.
Sulfitoxidas är ett metallenzym som använder en molybdopterin -kofaktor och en hemgrupp (i ett fall med djur). Det är en av cytokromerna b 5 och tillhör enzymsuperfamiljen av molybdenoxotransferaser som även inkluderar DMSO-reduktas , xantinoxidas och nitritreduktas .
Hos däggdjur är uttrycksnivåerna av sulfitoxidas höga i levern, njurarna och hjärtat och mycket låga i mjälten, hjärnan, skelettmuskulaturen och blodet.
Strukturera
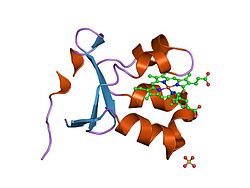
Som en homodimer innehåller sulfitoxidas två identiska subenheter med en N-terminal domän och en C-terminal domän. Dessa två domäner är sammankopplade av tio aminosyror som bildar en loop. Den N-terminala domänen har en hem- kofaktor med tre intilliggande antiparallella beta-ark och fem alfa-helixar . Den C-terminala domänen är värd för en molybdopterin-kofaktor som är omgiven av tretton beta-ark och tre alfa-helixar. Molybdopterin- kofaktorn har ett Mo(VI)-centrum, som är bundet till ett svavel från cystein , ett en-ditiolat från pyranopterin och två terminala syrgaser. Det är vid detta molybdencentrum som den katalytiska oxidationen av sulfit äger rum.
Pyranopterinliganden som koordinerar molybdencentrum via enditiolatet. Molybdencentret har en kvadratisk pyramidal geometri och särskiljs från xantinoxidasfamiljen genom att oxogruppen är vänd nedåt snarare än uppåt.
Aktiv plats och mekanism
Det aktiva stället för sulfitoxidas innehåller molybdopterin- kofaktorn och stödjer molybden i dess högsta oxidationstillstånd, +6 (Mo VI ). I enzymets oxiderade tillstånd koordineras molybden av ett cysteintiolat, ditiolengruppen av molybdopterin och två terminala syreatomer ( oxos ). Vid reaktion med sulfit överförs en syreatom till sulfit för att producera sulfat, och molybdencentrum reduceras med två elektroner till Mo IV . Vatten tränger sedan undan sulfat, och avlägsnandet av två protoner (H + ) och två elektroner (e - ) återför den aktiva platsen till dess ursprungliga tillstånd. En nyckelfunktion hos detta syreatomöverföringsenzym är att syreatomen som överförs härrör från vatten, inte från dioxygen (O 2 ).
Elektroner passerar en i taget från molybdenet till hemgruppen som reagerar med cytokrom c för att återoxidera enzymet. Elektronerna från denna reaktion går in i elektrontransportkedjan (ETC).
Denna reaktion är i allmänhet den hastighetsbegränsande reaktionen. Vid reaktion av enzymet med sulfit reduceras det med 2 elektroner. Den negativa potential som ses vid återreduktion av enzymet visar att det oxiderade tillståndet gynnas.
Bland Mo-enzymklasserna är sulfitoxidas det som är lättast att oxidera. Även om den oxidativa reaktionen under låga pH-förhållanden blir delvis hastighetsbegränsande.
Brist
Sulfitoxidas krävs för att metabolisera de svavelhaltiga aminosyrorna cystein och metionin i livsmedel. Brist på funktionellt sulfitoxidas orsakar en sjukdom som kallas sulfitoxidasbrist. Denna sällsynta men dödliga sjukdom orsakar neurologiska störningar, mental retardation, fysiska missbildningar, nedbrytning av hjärnan och död. Orsaker till bristen på funktionellt sulfitoxidas inkluderar en genetisk defekt som leder till frånvaron av en molybdopterin -kofaktor och punktmutationer i enzymet. En G473D-mutation försämrar dimerisering och katalys i humant sulfitoxidas.
Se även
Vidare läsning
- Kisker, C. "Sulfite oxidase", Messerschimdt, A.; Huber, R.; Poulos, T.; Wieghardt, K.; eds. Handbook of Metalloproteins, vol 2; John Wiley and Sons, Ltd: New York, 2002
- Feng C, Wilson HL, Hurley JK, et al. (2003). "Väsentlig roll för konserverad arginin 160 i intramolekylär elektronöverföring i humant sulfitoxidas". Biokemi . 42 (42): 12235–42. doi : 10.1021/bi0350194 . PMID 14567685 .
- Lee HF, Mak BS, Chi CS, et al. (2002). "En ny mutation i neonatal isolerad sulfitoxidasbrist". Neuropediatrik . 33 (4): 174–9. doi : 10.1055/s-2002-34491 . PMID 12368985 .
- Steinberg KK, Relling MV, Gallagher ML, et al. (2007). "Genetiska studier av ett kluster av akut lymfoblastisk leukemi i Churchill County, Nevada" . Environ. Hälsoperspektiv . 115 (1): 158–64. doi : 10.1289/ehp.9025 . PMC 1817665 . PMID 17366837 .
- Kimura K, Wakamatsu A, Suzuki Y, et al. (2006). "Diversifiering av transkriptionsmodulering: storskalig identifiering och karakterisering av förmodade alternativa promotorer av mänskliga gener" . Genome Res . 16 (1): 55–65. doi : 10.1101/gr.4039406 . PMC 1356129 . PMID 16344560 .
- Wilson HL, Wilkinson SR, Rajagopalan KV (2006). "G473D-mutationen försämrar dimerisering och katalys i humant sulfitoxidas". Biokemi . 45 (7): 2149–60. doi : 10.1021/bi051609l . PMID 16475804 .
- Hoffmann C, Ben-Zeev B, Anikster Y, et al. (2007). "Magnetisk resonanstomografi och magnetisk resonansspektroskopi vid isolerad sulfitoxidasbrist". J. Child Neurol . 22 (10): 1214–21. doi : 10.1177/0883073807306260 . PMID 17940249 . S2CID 24050167 .
- Johnson JL, Coyne KE, Garrett RM, et al. (2002). "Isolerad sulfitoxidasbrist: identifiering av 12 nya SUOX-mutationer hos 10 patienter" . Brum. Mutat . 20 (1): 74. doi : 10.1002/humu.9038 . PMID 12112661 . S2CID 45465780 .
- Woo WH, Yang H, Wong KP, Halliwell B (2003). "Sulfitoxidas-genuttryck i mänsklig hjärna och i andra mänskliga och råttvävnader". Biochem. Biophys. Res. Commun . 305 (3): 619–23. doi : 10.1016/S0006-291X(03)00833-7 . PMID 12763039 .
- Feng C, Wilson HL, Tollin G, et al. (2005). "De patogena humana sulfitoxidasmutanterna G473D och A208D är defekta i intramolekylär elektronöverföring". Biokemi . 44 (42): 13734–43. doi : 10.1021/bi050907f . PMID 16229463 .
- Tan WH, Eichler FS, Hoda S, et al. (2005). "Isolerad sulfitoxidasbrist: en fallrapport med en ny mutation och genomgång av litteraturen". Pediatrik . 116 (3): 757–66. doi : 10.1542/peds.2004-1897 . PMID 16140720 . S2CID 6506338 .
- Astashkin AV, Johnson-Winters K, Klein EL, et al. (2008). "Strukturstudier av molybdencentrum av den patogena R160Q-mutanten av humant sulfitoxidas genom pulsad EPR-spektroskopi och 17O- och 33S-märkning" . J. Am. Chem. Soc . 130 (26): 8471–80. doi : 10.1021/ja801406f . PMC 2779766 . PMID 18529001 .
- Dronov R, Kurth DG, Möhwald H, et al. (2008). "Lager-för-lager-arrangemang genom protein-protein-interaktion av sulfitoxidas och cytokrom c som katalyserar oxidation av sulfit". J. Am. Chem. Soc . 130 (4): 1122–3. doi : 10.1021/ja0768690 . PMID 18177044 .
- Edwards MC, Johnson JL, Marriage B, et al. (1999). "Isolerad sulfitoxidasbrist: genomgång av två fall i en familj". Oftalmologi . 106 (10): 1957–61. doi : 10.1016/S0161-6420(99)90408-6 . PMID 10519592 .
- Gerhard DS, Wagner L, Feingold EA, et al. (2004). "Status, kvalitet och expansion av NIHs fullängds cDNA-projekt: Mammalian Gene Collection (MGC)" . Genome Res . 14 (10B): 2121–7. doi : 10.1101/gr.2596504 . PMC 528928 . PMID 15489334 .
- Rudolph MJ, Johnson JL, Rajagopalan KV, Kisker C (2003). "1.2 A-strukturen för den humana sulfitoxidas-cytokrom b(5)-domänen". Acta Crystallogr. D . 59 (Pt 7): 1183–91. doi : 10.1107/S0907444903009934 . PMID 12832761 .
- Feng C, Wilson HL, Hurley JK, et al. (2003). "Roll av konserverad tyrosin 343 i intramolekylär elektronöverföring i humant sulfitoxidas" . J. Biol. Chem . 278 (5): 2913–20. doi : 10.1074/jbc.M210374200 . PMID 12424234 .
- Neumann M, Leimkühler S (2008). "Tungmetalljoner hämmar molybdoenzymaktivitet genom att binda till ditiolendelen av molybdopterin i Escherichia coli" . FEBS J . 275 (22): 5678–89. doi : 10.1111/j.1742-4658.2008.06694.x . PMID 18959753 . S2CID 45452761 .
- Strausberg RL, Feingold EA, Grouse LH, et al. (2002). "Generering och initial analys av mer än 15 000 fullängds human- och mus-cDNA-sekvenser" . Proc. Natl. Acad. Sci. USA . 99 (26): 16899–903. Bibcode : 2002PNAS...9916899M . doi : 10.1073/pnas.242603899 . PMC 139241 . PMID 12477932 .
- Wilson HL, Rajagopalan KV (2004). "Tyrosin 343:s roll i substratbindning och katalys av humant sulfitoxidas" . J. Biol. Chem . 279 (15): 15105–13. doi : 10.1074/jbc.M314288200 . PMID 14729666 .
- Hakonarson H, Qu HQ, Bradfield JP, et al. (2008). "Ett nytt känslighetslokus för typ 1-diabetes på Chr12q13 identifierat av en genomomfattande associationsstudie" . Diabetes . 57 (4): 1143–6. doi : 10.2337/db07-1305 . PMID 18198356 .
externa länkar
- Sulfit+oxidas vid US National Library of Medicine Medical Subject Headings (MeSH)
- Forskningsverksamhet för Sarkar Group
- PDBe-KB ger en översikt över all strukturinformation som finns tillgänglig i PDB för humant sulfitoxidas, mitokondrie




