Pulmonell atresi med ventrikulär septumdefekt
| Pulmonell atresi med ventrikulär septumdefekt | |
|---|---|
| Andra namn | PA-VSDS (förkortning) |
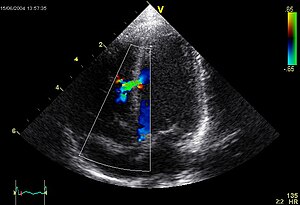 | |
| En ventrikulär septumdefekt , ett av symptomen på detta tillstånd, under ett ultraljud . | |
| Specialitet | Medicinsk genetik |
| Riskfaktorer | Genetiska och miljömässiga faktorer kommer vanligtvis på plats |
| Diagnostisk metod | Radiologiska studier som CT-skanningar av bröstet. |
| Differentialdiagnos | Pulmonell atresi |
| Prognos | fattiga utan behandling |
| Frekvens | sällsynt |
| Dödsfall | obehandlade PAVSD-patienter mer benägna att drabbas av en för tidig död |
Pulmonell atresi med ventrikulär septumdefekt är en sällsynt fosterskada som kännetecknas av pulmonell klaffatresi som uppstår vid sidan av en defekt i den högra ventrikulära utflödeskanalen.
Det är en typ av medfödd hjärtsjukdom/defekt , och en av de två erkända subtyperna av pulmonell atresi , den andra är pulmonell atresi med intakt ventrikulär septum.
tecken och symtom
Tillståndet består av atresi som påverkar lungklaffen och en hypoplastisk högerkammarutflödeskanal. Den ventrikulära septumdefekten hindrar inte in- och utflödet av blod i ventrikulär septum, vilket hjälper det att bildas under fosterlivet.
Spektrum av symtom som barn med detta tillstånd uppvisar beror på tillståndets svårighetsgrad, medan vissa knappt visar symtom, andra kan utveckla komplikationer som kronisk hjärtsvikt .
Hos symtomatiska barn blir symtom uppenbara strax efter födseln, dessa består vanligtvis av följande:
- Cyanos
- Andningssvårigheter
- Matningssvårigheter
- Utmattning under matning
- Hjärtblåsljud
- Överdriven sömnighet under dagen
- Klibbig hud
Andra egenskaper kan förekomma vid sidan av denna fosterskada, inklusive andra medfödda anomalier såsom polydaktyli , mikrocefali , medfödd hörselnedsättning (sensorineural typ), njuragenes , dextrokardi , etc.
Tillståndet har kallats en allvarlig form av Tetralogy of Fallot .
Om deformerade blodkärl som kommer från bröstaortan uppträder vid sidan av detta tillstånd, döps fenotypen om till pulmonell atresi med ventrikulär septumdefekt och större aortopulmonära kollateraler.
Komplikationer
Barn med detta tillstånd löper en högre risk att utveckla följande komplikationer:
- Underlåtenhet att frodas
- Återkommande bröstinfektioner
- Endokardit
- Epilepsi
- Stroke
- Arytmi
- Hjärtsvikt
- För tidig död
Barn vars PAVSD orsakas av DiGeorges syndrom (även känt som 22q11.2 deletionssyndrom) är mer benägna att drabbas av postkirurgiska komplikationer (särskilt de respiratoriska) i samband med operationer som behandlar denna defekt.
Kvinnor med PAVSD löper en något högre risk att bli infertila och få missfall eller barn med ett medfött hjärtfel.
Luftvägsöverkänslighet är en vanlig samsjuklighet bland de som lider av PAVSD.
Patogenes
Pulmonell atresi vid PAVSD äger rum under de första 8 veckorna av fosterlivet, när lungklaffen som ska bildas inte bildas, detta tillåter inte blod att strömma genom lungartären från höger kammare. Den ventrikulära septumdefekten associerad med PAVSD låter den högra ventrikeln bildas.
I vissa fall av PAVSD utvecklas stora aortopulmonära kollaterala artärer; hos ett normalt foster utvecklas dessa artärer vanligtvis men börjar sedan försämras efter att lungartärerna växer, hos foster med PAVSD utvecklas inte lungartärerna, och detta ger en chans för de stora aortopulmonära kollaterala artärerna att utvecklas fullt ut.
Patofysiologi
Den mildaste varianten av lungatresi med ventrikulär septumdefekt innebär lungatresi med normalt utvecklad huvudlungartär och grenartärer i lungorna, blodet som rinner till lungorna från höger sida av hjärtat går till vänster sida av hjärtat genom kammarskiljeväggen. som sedan rinner genom den patenterade ductus arteriosus . Den allvarligaste varianten involverar närvaron av allvarligt hypoplastiska huvudlungartärer och grenartärer i lungorna, tillsammans med agenesis av den patenterade ductus arteriosus. Blodflödet till lungorna kommer från olika dysplastiska (missbildade) blodkärl från bröstaortan som kallas stora aortapulmonella kollaterala artärer , dessa blodkärl smalnar av med tiden.
Orsaker
Även om denna fosterskada är medfödd, den exakta orsaken är okänd och den kan variera mellan barn med tillståndet, har följande faktorer varit kända för att påverka risken för att ett barn föds med tillståndet:
Genetik
Den molekylära genetiken för detta tillstånd är inte känd hos de flesta människor med PA(VSD), men det har funnits kandidatgener som möjligen är inblandade i patogenesen av detta tillstånd:
Det har också funnits kopianummervarianter som beskrivs i den medicinska litteraturen som associerade med PA(VSD):
- Deletion i kromosom 16p11.2
- Deletion i kromosom 5q35.3
- Deletion i kromosom 5p13.1
- Deletion i kromosom 22q11.2
- Deletion i kromosom 15q11.2
- Deletion i kromosom 8p23.2
- Deletion i kromosom 17p13.2
- Duplicering i kromosom 5q14.1
- Duplicering i kromosom 10p13
En studie från 1998 gjord i Storbritannien avslöjade att barn med en mamma som hade ett medfött hjärtfel (inklusive PAVSD) hade en högre risk att själva födas med ett medfött hjärtfel än de vars pappa hade ett medfött hjärtfel.
Syndrom
Vissa fall av PA(VSD) har associerats med genetiska syndrom som VACTERL-association , Alagille-syndrom , CHARGE-syndrom , trisomi 13 , 18 och 21 .
Miljö
Även om medfödda hjärtfel inte kan förvärvas, kan de också orsakas av miljöfaktorer som mamman utsatte sig för före och/eller under graviditeten, dessa inkluderar:
- Rökning
- Vissa mediciner (t.ex. talidomid , retinoider eller vitamin A coegers)
- Alkoholkonsumtion
- Fordons avgaskomponenter
- Biprodukter av desinfektionsmedel
- Förbränningsugnar (närhet)
- Jordbruksbekämpningsmedel
- Lösningsmedel
- Deponier
- Tungmetaller
Moderns exponering för kolmonoxid från rök (t.ex. från cigaretter) har varit känd för att ha förmågan att snabbt passera moderkakan in i fostret, som sedan fäster sig på fostrets hemoglobin, vilket ger brist på näringsämnen och syre som ett resultat. Ett samband mellan dessa händelser och medfödd hjärtsjukdom (inklusive PAVSD) har visats i 3 senaste metaanalyser.
Faderns rökning (det vill säga rökning av fadern) har också visat sig vara en bidragande faktor till medfödd hjärtsjukdom; medan lätt rökning något ökade risken för att mannens avkomma skulle få ett (medfött) konotrunkalt hjärtfel, fördubblade kraftig rökning av mer än 14 cigaretter om dagen risken för att mannen skulle få ett barn med medfödd hjärtsjukdom. Högre mängder än detta var kopplade till en högre risk att få barn med septumdefekter och/eller obstruktion av den vänstra kammarens utflödeskanal.
Andra riskfaktorer inkluderar fetma hos modern , diabetes , röda hund, tokolys av indometacin, fenylketonuri eller äldre ålder.
Multifaktoriell: involverar genetiska och miljömässiga faktorer på samma gång
En koppling mellan vissa gener och moderns rökning har visat sig öka chansen att få barn med medfödd hjärtsjukdom (inklusive PAVSD): mödrar som har en CC-genotyp vid position 677 av MTHFR -genen har en ökad chans att ha en CHD-riden barn. Andra gener som ökar risken för ett barn med CHD hos rökande mödrar som bär genetiska variationer i dem inkluderar ERCC1 , ERCC5 , PARP2 och OSGEP .
Diagnos
Det finns olika sätt att diagnostisera detta medfödda hjärtfel både prenatalt och postnatalt, dessa metoder inkluderar:
- Ultraljud
- Pulsoximetri
- Bröströntgen _
- Ekokardiogram
- Elektrokardiogram
- Hjärtkateterisering
- Hjärt- CT-skanning
- Genetisk testning (särskilt om andra systemiska födelseanomalier ses vid sidan av pulmonell atresi och ventrikulär septumdefekt).
Förvaltning
När störningen upptäcks (vanligtvis före eller strax efter födseln) kommer prostaglandin att användas tillfälligt så snart som möjligt för att hålla ductus arteriosus öppen så länge som möjligt tills operation kan göras, detta görs så att blodet kan fortsätta att flöda till lungorna, eftersom kroppar av spädbarn med pulmonell atresi vanligtvis använder ductus arteriosus för lungblodflöde prenatalt fram till födseln, varefter det stängs.
Efteråt hanteras denna anomali vanligtvis med operationer för att förbättra blodflödet och hjärtats funktion, även om vilken typ av behandling man får beror på strukturen i hjärt- och andningssystemet.
De kirurgiska metoder som kan användas för att behandla (på lång sikt) detta tillstånd inkluderar:
- Kateteringrepp för lungartärförgreningar
- Systemisk-till-lungartärshunt
- Neonatal komplett reparation
- Enstegs komplett reparation
- Ballongseptostomi
- Iscensatt unifokalisering
Frekvens
Frekvensuppskattningar varierar mellan populationer, uppskattningar sträcker sig från 0,01 % till 0,2 % av levande födslar med PAVSD. Det tros kompensera för 1-2% av fallen av medfödda hjärtfel i världen.
Av alla patienter med PAVSD har cirka 25–32 % av dem en mikrodeletion av 22q11.2-kromosomen.
Prognos
Utan behandling är det ett mycket livshotande tillstånd, så prognosen är dålig. Om operation inte utförs i allvarliga fall kan (och kommer) barnet att dö, eftersom fenotypen av lungatresi inte är förenlig med livet på grund av lungklaffatresin som resulterar i minskad blodsyresättning.
Den förväntade livslängden för obehandlade barn med PAVSD är 10 år. Överlevnadsfrekvensen för obehandlade personer med denna defekt har rapporterats vara 50 % vid det tionde decenniet och 10 % vid det tjugonde decenniet, och av dessa obehandlade patienter har de som inte har stora aortopulmonära artärer en högre chans att leva till sina 30-talet än de som har det, eftersom de senare har 40% chans att överleva till det tionde decenniet och 20% chans att göra det till det trettionde decenniet.
Prognos efter kirurgiskt ingrepp är generellt sett god.
Historia
Denna kombination av fosterskador beskrevs första gången 1980 av DiChiara et al., deras patienter var en far och hans son från USA som båda hade pulmonell atresi och en ventrikulär septumdefekt. Fram till den tidpunkten hade det inte förekommit några familjära fall av PA med en VSD. En multifaktoriell etiologi (det vill säga en orsak som involverar genetik och miljö) misstänktes hos dessa patienter och de erbjöds medicinsk rådgivning för tillståndet.
Från och med 2011 var den äldsta patienten med obehandlad PAVSD en 59-årig kvinna från Japan. Hennes tillstånd upptäcktes i barndomen men hon vägrade att genomgå någon operation för att behandla det (inklusive hjärtkateterisering), hon utvecklade dyspné under tonåren. Radiologiska studier visade en ventrikulär septumdefekt tillsammans med hjärt- och artäravvikelser (hjärtsilhuettförstoring, förhöjning av hjärtspetsen, förekomst av en höger aortabåge, förstoring som påverkar de viktigaste lungartärerna och deras huvudgrenar, hög lungartärvaskularitet och ventrikeldefekt ).