PTPRK
| PTPRK | |||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | |||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||
| Identifierare | |||||||||||||||||||||||||||||||||||||||||||||||
| , R-PTP-kappa, proteintyrosinfosfatas, receptortyp K, proteintyrosinfosfatasreceptortyp K | |||||||||||||||||||||||||||||||||||||||||||||||
| Externa ID:n | |||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||
| Wikidata | |||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||
Receptortyp tyrosin-protein fosfatas kappa är ett enzym som hos människor kodas av PTPRK -genen . PTPRK är också känt som PTPkappa och PTPκ.
Fungera
Proteinet som kodas av denna gen är en medlem av familjen proteintyrosinfosfatas (PTP). Proteintyrosinfosfataser är proteinenzymer som tar bort fosfatgrupper från tyrosinrester på andra proteiner. Tyrosinkinaser är enzymer som tillför fosfater till tyrosinrester, och är de motsatta enzymerna till PTP. PTP är kända för att vara signalmolekyler som reglerar en mängd cellulära processer inklusive celltillväxt, differentiering, mitotisk cykel och onkogen transformation.
Den humana PTPRK-genen är lokaliserad på den långa armen av kromosom 6, en förmodad tumörsuppressorregion i genomet.
Under utveckling
Samma reporterkonstruktion som användes av Shen och kollegor och som beskrivs ovan skapades av Skarnes et al. under en screening för att identifiera gener som är viktiga för musutveckling. Den transgena musen skapades genom att kombinera en β-galaktosidas (β-gal) reportergen med en signalsekvens och transmembrandomänen av typ I-transmembranproteinet CD4. Om transgenen inkorporerades i en gen med en signalsekvens skulle β-gal-aktivitet förbli i cellens cytosol och därför vara aktiv. Om reportergenen inkorporerades i en gen som saknade en signalsekvens skulle β-gal-aktivitet vara i ER där den skulle förlora β-gal-aktivitet. Denna konstruktion infogades i fosfatasdomänen av PTPkappa. Möss genererade från dessa ES-celler var livsdugliga, vilket tyder på att PTPkappa-fosfatasaktivitet inte är nödvändig för embryonal utveckling.
Ytterligare studier har föreslagit en funktion för PTPkappa under nervsystemets utveckling. PTPkappa främjar neuritutväxt från embryonala cerebellära neuroner och kan således vara involverad i axonal förlängning eller vägledning in vivo. Neuriter är förlängningar från neuroner som kan betraktas som motsvarigheten in vitro till axoner och dendriter. Förlängningen av cerebellära neuriter på renade PTPkappa-fusionsproteiner visades kräva Grb2- och MEK1-aktivitet.
I T-celler
PTPkappa har också visat sig reglera CD4+ positiv T-cellsutveckling. PTPkappa och THEMIS -genen är båda deleterade i Long-Evans Cinnamon (LEC)-stammen från råtta och krävs båda för CD4+ T-cellsbristen som observerats i denna råttstam. Deletion av PTPkappa visades generera T-hjälpar-immunbrist i LEC-stammen.
Genom att uttrycka en dominant negativ form av PTPkappa eller genom att använda kort hårnåls-RNA för PTPkappa i benmärgshärledda stamceller, hämmas utvecklingen av CD4(+) T-celler. PTPkappa reglerar troligen T-cellsutveckling genom att positivt reglera ERK1/2-fosforylering via regleringen av MEK1/2- och c-Raf-fosforylering.
Cadherin-catenin signalering
PTPkappa är lokaliserat till cell-cell-kontaktställen, där det kolokaliserar och samimmunoutfälls med β-catenin och plakoglobin/γ-catenin β-catenin kan vara ett PTPkappa-substrat. Närvaron av fullängds PTPkappa i melanomceller minskar nivån av fritt-cytosoliskt β-catenin, vilket följaktligen minskar nivån av nukleärt β-catenin och minskar uttrycket av de β-catenin-reglerade generna, cyklin D1 och c-myc . Uttryck av fullängds PTPkappa i melanomceller som normalt saknar dess uttryck resulterar i minskad cellmigration och cellproliferation. Eftersom närvaron av PTPkappa vid cellmembranet visade sig binda β-catenin till plasmamembranet, antyder dessa data att en mekanism genom vilken PTPkappa fungerar som en tumörsuppressor är genom att reglera den intracellulära lokaliseringen av fritt-β-catenin.
De intracellulära fragmenten av PTPkappa, PΔE och PIC, är katalytiskt aktiva och kan även defosforylera β-catenin. Tyrosinfosforylerat β-catenin translokerar till cellkärnan och aktiverar TCF-medierad transkription för att främja cellproliferation och migration. Medan fullängds PTPkappa antagoniserar TCF-medierad transkription, förstärker PIC-fragmentet den, kanske genom att reglera andra proteiner i TCF-medierad transkription. Detta tyder på att fosfatasaktiviteten hos PIC-fragmentet motsätter sig den hos fullängds PTPkappa.
PTPkappa interagerar genom samtidig immunoprecipitation med E-cadherin, α-catenin och β-catenin i pankreatiska acinära celler före upplösningen av adherens-övergångar i en råttmodell av pankreatit. Författarna föreslår att närvaron av PTPkappa vid plasmamembranet i förening med cadherin/catenin-komplexet är viktig för upprätthållandet av adherens-övergången i pankreatiska acinära celler, ungefär som det föreslogs ovan i melanomceller.
EGFR-signalering
Användning av kort interfererande RNA (siRNA) av PTPkappa för att minska PTPkappa-proteinuttrycket i bröstepitelcellinjen, MCF10A, resulterade i ökad cellproliferation. PTPkappa-uttryck, omvänt, visades minska cellproliferation i kinesisk hamster-äggstocksceller. Mekanismen som föreslås för att förklara påverkan av PTPkappa på cellproliferation är via PTPkappa-defosforylering av EGFR på tyrosiner 1068 och 1173 direkt. Minskningen av PTPkappa-uttryck i CHO-celler med PTPkappa siRNA ökade EGFR-fosforylering. Därför är hypotesen att PTPkappa fungerar som en tumörsuppressorgen genom att defosforylera och inaktivera EGFR.
Dessutom har glykosylering av N-acetylglukosaminyltransferas-V (GnT-V) visat sig reducera PTPkappa-uttryck i full längd, troligen genom att öka dess klyvning. Denna avvikande glykosylering har visat sig öka fosforyleringen av EGFR på tyrosin 1068, troligen på grund av minskat plasmamembranassocierat PTPkappa-uttryck och därmed minskad PTPkappa-medierad defosforylering av dess membranassocierade substrat, såsom EGFR.
Strukturera
PTPkappa har en extracellulär region, en enkel transmembranregion och två katalytiska tandemdomäner och representerar således en receptortyp PTP (RPTP). Den extracellulära regionen innehåller en meprin-A5-antigen-PTP mu (MAM) domän, en Ig-liknande domän och fyra fibronektin typ III-liknande upprepningar. PTPkappa är medlem i R2B-underfamiljen av RPTP, som inkluderar RPTPM, RPTPT och RPTPU . PTPkappa delar mest sekvenslikhet med PTPmu och PTPrho.
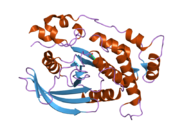
Kristallstrukturanalys av den första fosfatasdomänen av PTPkappa visar att den delar många konformationella egenskaper med PTPmu, inklusive en obehindrad öppen konformation för den katalytiskt viktiga WPD-loopen och en fosfatbindande loop för cysteinet på det aktiva stället (Cys1083). PTPkappa existerar som en monomer i lösning, med förbehållet att dimerer av PTPkappa observeras beroende på typen av buffert som används.
Alternativ skarvning
Alternativ splitsning av exonerna 16, 17a och 20a har beskrivits för PTPRK. Två nya former av PTPRK identifierades från mus fullängds cDNA-sekvenser och förutspåddes resultera i två PTPkappa splitsningsvarianter: en utsöndrad form av PTPkappa och en membranbunden form.
Homofil bindning
PTPkappa förmedlar homofil cell-cellaggregation via dess extracellulära domän. PTPkappa förmedlar endast bindning mellan celler som uttrycker PTPkappa (dvs. homofil), och kommer inte att förmedla cellaggregation mellan celler som uttrycker PTPkappa, PTPmu eller PTPrho (dvs. heterofil).
förordning
Proteolys och N-glykosylering
Fullängds PTPkappa-protein klyvs av furin för att generera två klyvda fragment som förblir associerade vid plasmamembranet, en extracellulär (E) subenhet och en intracellulär fosfatas (P) subenhet. Som svar på hög celltäthet eller kalciuminflöde efter stimulering av trifluoperazin (TFP) klyvs PTPkappa ytterligare av ADAM 10 för att ge ett extracellulärt fragment och ett membranbundet intracellulärt fragment, PΔE. Det membranbundna PΔE-fragmentet klyvs ytterligare av gamma-sekretaskomplexet för att ge ett membranfrisatt fragment, PIC, som kan translokera till cellkärnan, där det är katalytiskt aktivt.
Glykosylering av den extracellulära domänen av PTPkappa visades företräde företräde i WiDr koloncancerceller som överuttrycker N-acetylglukosaminyltransferas V (GnT-V). Överuttryck av GnT-V i dessa celler ökade klyvningen och utsöndringen av PTPkappa-ektodomän och ökade migration av WiDr-celler i transwell-analyser. Som ett resultat av glykosylering av PTPkappa av GnT-V, fosforylerades EGFR på tyrosin 1068 och aktiverades, och är troligen orsaken till den ökade cellmigration som observerats efter PTPkappa-klyvning.
Utsöndring av PTPkappa kan också regleras av närvaron av galectin-3-bindande protein, vilket har visats i WiDr-celler. Författarna föreslår att förhållandet mellan galectin-3-bindande protein och galectin 3 påverkar klyvningen och utsöndringen av PTPkappa, även om den exakta mekanismen för hur dessa proteiner reglerar PTPkappa-klyvningen inte fastställdes.
Genom reaktiva syrearter i cancer
En mekanism genom vilken PTPkappa-tyrosinfosfatasaktivitet kan störas i cancer är via oxidativ inhibering medierad av reaktiva syrearter som genereras av antingen väteperoxid in vitro eller UV-bestrålning av hudceller in vivo. I cellfria analyser minskar närvaron av väteperoxid PTPkappa-tyrosinfosfatasaktiviteten och ökar EGFR-tyrosinfosforyleringen. UV-bestrålning av primära humana keratinocyter ger samma resultat, nämligen en minskning av PTPkappa-tyrosinfosfatasaktivitet och en ökning av EGFR-tyrosinfosforylering. EGFR-fosforylering leder sedan till cellproliferation, vilket tyder på att PTPkappa kan fungera som en tumörsuppressor vid hudcancer förutom melanom.
Uttryck
PTPkappa uttrycks i humana keratinocyter. TGFβ1 är en tillväxthämmare i humana keratinocyter. Stimulering av den odlade humana keratinocytcellinjen, HaCaT , med TGFβ1 ökar nivåerna av PTPkappa (PTPRK) mRNA som analyserats med northern blot-analys. TGFβ1 ökade också PTPkappa-mRNA och protein i normala och tumörbröstcellinjer. HER2-överuttryck minskade PTPkappa-mRNA och proteinuttryck.
Klinisk signifikans
Melanom och hudcancer
Expressionsanalys av PTPkappa-mRNA i normala melanocyter och i melanomceller och vävnader visade att PTPkappa är nedreglerad eller frånvarande 20 % av tiden i melanom, vilket tyder på att PTPkappa är en tumörsuppressorgen i melanom. En form av PTPkappa med en punktmutation i den fjärde fibronektin III-upprepningen identifierades vara ett melanomspecifikt antigen som känns igen av CD4+ T-celler hos en melanompatient med 10-års tumörfri överlevnad efter lymfkörtelresektion. Denna speciella muterade form av PTPkappa identifierades inte i 10 andra melanomcellinjer och kan således representera en unik mutation hos en patient.
Lymfom
PTPkappa identifierades också som den förmodade tumörsuppressorgenen som vanligtvis raderas i primära lymfom i centrala nervsystemet (PCNSL).
Nedreglering av PTPkappa visade sig inträffa efter Epstein-Barr Virus (EBV)-infektion av Hodgkins lymfomceller.
Kolorektal cancer
Med hjälp av en transposonbaserad genetisk screening fann forskarna att störningar av PTPRK-genen i mag-tarmkanalens epitel resulterade i en tarmskada, klassificerad som antingen en intraepitelial neoplasi, ett adenokarcinom eller ett adenom.
Lungcancer
PTPRK mRNA visades vara signifikant reducerad av RT-PCR i humana lungcancer-härledda cellinjer.
Prostatacancer
PTPRK har också visat sig nedregleras som svar på androgenstimulering i humana LNCaP prostatacancerceller. Mekanismen genom vilken PTPRK nedregleras är via uttrycket av ett mikroRNA, miR-133b, som uppregleras som svar på androgenstimulering.
Bröstcancer
Patienter med minskat PTPRK-transkriptuttryck har kortare överlevnadstider för bröstcancer och är mer benägna att få bröstcancermetastaser eller att dö i bröstcancer. I en experimentell modell av bröstcancer reducerades PTPRK i bröstcancercellinjer med PTPRK-ribozymer. I dessa celler ökade vidhäftning till matrigel, transwell-migrering och celltillväxt efter minskningen av PTPRK-uttryck, vilket återigen stödde en funktion för PTPRK som en tumörsuppressor.
Gliom
Assem och kollegor identifierade förlust av heterozygositet (LOH) händelser i maligna gliomprover och identifierade PTPRK som en signifikant genkandidat i en LOH-region. En signifikant korrelation mellan närvaron av PTPRK-mutationer och kort patientöverlevnadstid observerades. PTPRK amplifierades från tumör-cDNA för att bekräfta den observerade LOH. I dessa prover observerades 6 olika mutationer, varav två (en i varje fosfatasdomän) störde den enzymatiska aktiviteten hos PTPRK. Uttryck av vildtyp PTPkappa i U87-MG- och U251-MG-celler resulterade i en minskning av cellproliferation, migration och invasion. Uttryck av varianterna av PTPkappa med mutationer i fosfatasdomänerna ökade emellertid cellproliferation, migration och invasion, vilket stödde en roll för involveringen av de muterade varianterna av PTPkappa i tumörframkallande egenskaper.
Under utveckling
In situ-hybridisering lokaliserade PTPkappa-mRNA till hjärnan, lungan, skelettmuskulaturen, hjärtat, moderkakan, levern, njurarna och tarmarna under utveckling. PTPkappa visade sig också uttryckas i den utvecklande näthinnan, i nestinpositiva radiella progenitorceller och senare i utvecklingen, i ganglioncellskiktet, inre plexiforma skiktet och yttre segment av fotoreceptorer. PTPkappa-protein observeras också i neurala progenitorceller och radiella gliaceller i den utvecklande mus superior colliculus.
I den vuxna råtthjärnan uttrycks PTPkappa-mRNA i hög grad i delar av hjärnan med cellulär plasticitet och tillväxt, såsom luktbulben, hippocampus och hjärnbarken. PTPkappa-mRNA observeras också i lillhjärnan hos vuxna mus.
Med hjälp av en β-galaktosidas (β-gal) reportergen insatt i fosfatasdomänen av den murina PTPkappa (PTPRK) genen, bestämde Shen och kollegor det detaljerade uttrycksmönstret för endogen PTPRK. β-gal-aktivitet observerades i många områden av den vuxna framhjärnan, inklusive lager II och IV, och i mindre utsträckning i lager VI i cortex. β-gal-aktivitet observerades också i apikala dendriter av kortikala pyramidala celler, granulatskiktet av lukt- och accessoriska luktlökar, den främre hypotalamus, paraventrikulär kärna och i granulat och pyramidala lager av dentate gyrus och CA 1-3- regionerna av hippocampus. I mellanhjärnan observerades β-gal i subthalamuskärnan, colliculi överlägsna och nedre och i den röda kärnan. β-gal-aktivitet observerades också i den neurala näthinnan, i det inre kärnskiktet och i små ganglionceller i gangliecellskiktet.
Interaktioner
PTPRK har visat sig interagera med:
- Beta-catenin ,
- E-cadherin (CDH-1),
- Epidermal tillväxtfaktorreceptor (EGFR),
- HER2 ,
- Plakoglobin och
- a-catenin .
Vidare läsning
- Lu J, Li Q, Donadel G, Notkins AL, Lan MS (1998). "Profil och differentiellt uttryck av proteintyrosinfosfataser i tumörcellinjer i bukspottkörtelöar från mus" . Bukspottkörteln . 16 (4): 515–20. doi : 10.1097/00006676-199805000-00010 . PMID 9598814 . S2CID 35807441 .
- Bondar C, Plaza-Izurieta L, Fernandez-Jimenez N, Irastorza I, Withoff S, Wijmenga C, Chirdo F, Bilbao JR (2013). "THEMIS och PTPRK i celiaki tarmslemhinna: samuttryck vid sjukdom och efter in vitro gliadinutmaning" . Eur J Hum Genet . 22 (3): 358–62. doi : 10.1038/ejhg.2013.136 . PMC 3925264 . PMID 23820479 .