Nukleosid fosforamidit
Nukleosidfosforamiditer är derivat av naturliga eller syntetiska nukleosider . De används för att syntetisera oligonukleotider , relativt korta fragment av nukleinsyra och deras analoger . Nukleosidfosforamiditer introducerades först 1981 av Beaucage och Caruthers. För att undvika oönskade sidoreaktioner är reaktiva hydroxi- och exocykliska aminogrupper närvarande i naturliga eller syntetiska nukleosider lämpligt skyddade. Så länge som en nukleosidanalog innehåller minst en hydroxigrupp, tillåter användningen av den lämpliga skyddsstrategin en att omvandla den till respektive fosforamidit och att införliva den senare i syntetiska nukleinsyror. För att införlivas i mitten av en oligonukleotidkedja med användning av fosforamiditstrategi måste nukleosidanalogen ha två hydroxigrupper eller, mer sällan, en hydroxigrupp och en annan nukleofil grupp (amino eller merkapto). Exempel inkluderar, men är inte begränsade till, alternativa nukleotider , LNA , morfolino , nukleosider modifierade i 2'-position (OMe, skyddad NH2 , F), nukleosider som innehåller icke-kanoniska baser ( hypoxantin och xantin som ingår i naturliga nukleosider inosin och xantosin , tricykliska baser såsom G-clamp, etc.) eller baser derivatiserade med en fluorescerande grupp eller en länkarm.
Förberedelse
Det finns tre huvudmetoder för framställning av nukleosidfosforamiditer.
- Den vanliga metoden innefattar behandling av en skyddad nukleosid som bär en enda fri hydroxigrupp med fosforodiamidit under katalytisk verkan av en svag syra. Även om vissa bisamiditer rapporterades som termiskt instabila föreningar, 2-cyanoetyl N,N,N',N'-tetraisopropylfosforodiamidit, är amiditen som används för att framställa kommersiella nukleosidfosforamiditer relativt stabil. Det kan syntetiseras med en tvåstegs, en-kärl-procedur och renas genom vakuumdestillation . En utmärkt recension beskriver användningen av det senare reagenset vid framställning av nukleosidiska och icke-nukleosidiska fosforamiditer i detalj.
- I den andra metoden behandlas den skyddade nukleosiden med fosforkloriditen i närvaro av en organisk bas, oftast N-etyl-N,N-diisopropylamin (Hunigs bas).
- I den tredje metoden behandlas den skyddade nukleosiden först med klor-N,N,N',N'-tetraisopropylfosforodiamidit i närvaro av en organisk bas, oftast N-etyl-N,N-diisopropylamin (Hunigs bas) för att bilda en skyddad nukleosid-diamidit. Den senare behandlas med en alkohol motsvarande den önskade fosfitskyddsgruppen, t.ex. 2-cyanoetanol, i närvaro av en svag syra.
Nukleosidfosforamiditer renas genom kolonnkromatografi på silikagel . För att garantera stabiliteten hos fosforamiditdelen är det tillrådligt att jämvikta kolonnen med ett elueringsmedel innehållande 3 till 5 % trietylamin och bibehålla denna koncentration i eluenten under hela separationsförloppet. Renheten hos en fosforamidit kan bedömas med 31P NMR -spektroskopi . Eftersom P(III)-atomen i en nukleosid-fosforamidit är kiral, uppvisar den två toppar vid cirka 149 ppm motsvarande de två diastereomererna av föreningen. Den potentiellt närvarande fosfittriesterföroreningen uppvisar en topp vid 138–140 ppm. H-fosfonatföroreningar uppvisar toppar vid 8 och 10 ppm.
Kemiska egenskaper hos fosforamiditdelen
Nukleosidfosforamiditer är relativt stabila föreningar med förlängd hållbarhet när de lagras som pulver under vattenfria förhållanden i frånvaro av luft vid temperaturer under 4 °C. Amiterna tål milda grundförhållanden. Däremot, i närvaro av till och med milda syror, försvinner fosforamiditer nästan omedelbart. Fosforamiditerna är relativt stabila mot hydrolys under neutrala betingelser. Till exempel är halveringstiden för 2-cyanoetyl 5'- O- (4,4'-dimetoxitrityl) tymidin -3'- O- (N,N-diisopropylamino)fosfit i 95 % vattenhaltig acetonitril vid 25 °C 200 timmar .
- Den viktigaste egenskapen hos fosforamiditer är deras förmåga att genomgå fosforamiditkopplingsreaktionen, det vill säga att reagera med nukleofila grupper i närvaro av en sur azolkatalysator , 1H - tetrazol , 2-etyltiotetrazol, 2-bensyltiotetrazol, 4,5-dicano. imidazol eller ett antal liknande föreningar. Reaktionen fortskrider extremt snabbt. Just denna egenskap gör nukleosidfosforamiditer användbara mellanprodukter i oligonukleotidsyntes . Stereokemiskt leder fosforamiditkopplingen till epimerisering (bildande av diastereomerer ) vid P(III) kirala centrum.
När vatten serveras som en nukleofil är produkten en H-fosfonatdiester som visas i schemat ovan. På grund av närvaron av kvarvarande vatten i lösningsmedel och reagens är bildningen av den senare föreningen den vanligaste komplikationen vid den preparativa användningen av fosforamiditer, särskilt vid oligonukleotidsyntes.
- Fosforamiditer oxideras lätt med svaga oxiderande reagens, till exempel med vattenhaltig jod i närvaro av svaga baser eller med väteperoxid för att bilda respektive fosforamidater.
På liknande sätt reagerar fosforamiditer med andra kalkogener . När de kommer i kontakt med en lösning av svavel eller ett antal föreningar som kollektivt kallas sulfuriseringsmedel , bildar fosforamiditer kvantitativt fosfortioamidater. Reaktionen med selen eller selenderivat ger fosforselenamidater. I alla reaktioner av denna typ bibehålls konfigurationen vid fosforatomen.
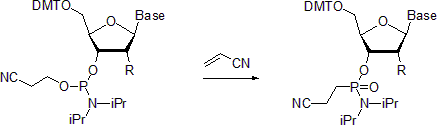
- Nukleosidfosforamiditer genomgår en Michaelis-Arbuzov-reaktion för att bilda respektive fosfonamidater. Ett exempel beskriver framställningen av fosfonamidater i närvaro av akrylnitril. Enligt uppgift är reaktionen stereoselektiv vid rumstemperatur med bibehållande av konfigurationen vid fosforcentrum. När den utförs vid 55°C leder reaktionen däremot till racemiserade produkter.
- På samma sätt som fosfiner och tertiära fosfiter genomgår fosforamiditer lätt Staudinger-reaktion .
(RO) 2P -N(R1 ) 2 + R2 - N3 + H2O ---- (RO) 2P (=0)-N( R1 ) 2 + R2 - NH2 + N2 ;
Skyddsstrategi
De naturligt förekommande nukleotiderna (nukleosid-3'- eller 5'-fosfater) och deras fosfodiesteranaloger är otillräckligt reaktiva för att ge en snabb syntetisk framställning av oligonukleotider i höga utbyten. Selektiviteten och hastigheten för bildandet av internukleosidbindningar förbättras dramatiskt genom att använda 3'- O- ( N , N -diisopropylfosforamidit)-derivat av nukleosider (nukleosidfosforamiditer) som fungerar som byggstenar i fosfittriestermetodik. För att förhindra oönskade sidoreaktioner måste alla andra funktionella grupper närvarande i nukleosider göras oreaktiva (skyddade) genom att fästa skyddsgrupper . Efter fullbordandet av oligonukleotidkedjesammansättningen avlägsnas alla skyddsgrupper för att ge de önskade oligonukleotiderna. Nedan granskas kortfattat de skyddsgrupper som för närvarande används i kommersiellt tillgängliga och vanligaste nukleosidfosforamiditbyggstenar:
- 5'-hydroxylgruppen skyddas av en syralabil DMT (4,4'-dimetoxitrityl) grupp.
- Tymin och uracil , nukleinbaser av tymidin respektive uridin , har inte exocykliska aminogrupper och kräver därför inget skydd. Däremot bär nukleinbaserna adenin , cytosin och guanin de exocykliska aminogrupperna, som är reaktiva med de aktiverade fosforamiditerna under betingelserna för kopplingsreaktionen. Även om, på bekostnad av ytterligare steg i syntescykeln, oligonukleotidkedjesammansättningen kan utföras med användning av fosforamiditer med oskyddade aminogrupper, hålls dessa oftast permanent skyddade över hela längden av oligonukleotidkedjesammansättningen. Skyddet av de exocykliska aminogrupperna måste vara ortogonalt mot det för 5'-hydroxigruppen eftersom den senare avlägsnas i slutet av varje syntescykel. Den enklaste att implementera och därmed den mest accepterade är strategin där de exocykliska aminogrupperna har ett baslabilt skydd. Oftast används två skyddssystem.
- I det första, det vanliga och mer robusta schemat (Figur), Bz (bensoyl) skydd används för A, dA, C, dC, G och dG är skyddade med isobutyrylgrupp. På senare tid används ofta Ac (acetyl) grupp för att skydda C och dC som visas i figur.
- I det andra milda skyddsschemat skyddas A och dA med isobutyryl- eller fenoxiacetylgrupper (PAC). C och dC har acetylskydd, och G och dG är skyddade med 4-isopropylfenoxiacetyl (i-Pr-PAC) eller dimetylformamidino (dmf) grupper. Milda skyddsgrupper avlägsnas lättare än standardskyddsgrupperna. Fosforamiditerna som bär dessa grupper är emellertid mindre stabila när de lagras i lösning.
- Fosfitgruppen skyddas av en baslabil 2-cyanoetylgrupp . När en fosforamidit väl har kopplats till den fasta bärarbundna oligonukleotiden och fosfitdelarna har omvandlats till P(V)-arterna, är närvaron av fosfatskyddet inte obligatorisk för framgångsrikt genomförande av ytterligare kopplingsreaktioner.
- Vid RNA-syntes skyddas 2'-hydroxigruppen med TBDMS ( t -butyldimetylsilyl)-gruppen. eller med TOM (tri- iso -propylsilyloximetyl) grupp, båda kan avlägsnas genom behandling med fluoridjon.
- Fosfitdelen bär också en diisopropylaminogrupp ( iPr2N ) som är reaktiv under sura betingelser . Vid aktivering lämnar diisopropylaminogruppen för att ersättas med 5'-hydroxigruppen i den bärarbundna oligonukleotiden.
Se även
- ^ Beaucage, SL; Caruthers MH (1981). "Deoxinukleosidfosforamiditer - En ny klass av nyckelmellanprodukter för deoxipolynukleotidsyntes". Tetraederbokstäver . 22 (20): 1859–1862. doi : 10.1016/S0040-4039(01)90461-7 .
-
^
Lin, K.-Y., Matteucci, MD (1998). "En cytosinanalog med förmåga att klämma-liknande binda till en guanin i spiralformade nukleinsyror". J. Am. Chem. Soc . 120 (33): 8531–8532. doi : 10.1021/ja981286z .
{{ citera tidskrift }}: CS1 underhåll: flera namn: lista över författare ( länk ) - ^ Nielsen, J.; Marugg, JE; Taagaard, M.; Van Boom, JH; Dahl, O. (1986). "Polymerstödd syntes av deoxioligonukleotider med användning av in situ framställda deoxinukleosid-2-cyanoetylfosforamiditer". Recl. Trav. Chim. Pays-Bas . 105 (1): 33–34. doi : 10.1002/recl.19861050106 .
- ^ Nielsen, J.; Taagaard, M.; Marugg, JE; Van Boom, JH; Dahl, O. (1986). "Tillämpning av 2-cyanoetyl N,N,N',N'-tetraisopropylfosforodiamidit för in situ framställning av deoxiribonukleosid fosforamiditer och deras användning vid polymerstödd syntes av oligodeoxiribonukleotider" . Nucleic Acids Res . 14 (18): 7391–7403. doi : 10.1093/nar/14.18.7391 . PMC 311758 . PMID 3763407 .
- ^ Nielsen, J.; Marugg, JE; Van Boom, JH; Honnens, J.; Taagaard, M.; Dahl, O. (1986). "Termisk instabilitet hos vissa alkylfosforodiamiditer". J. Chem. Res. Synopser (1): 26–27.
- ^ Nielsen, J.; Dahl, O. (1987). "Förbättrad syntes av 2-cyanoetyl N,N,N',N'-tetraisopropylfosforodiamidit (iPr2N)2POCH2CH2CN)" . Nucleic Acids Res . 15 (8): 3626. doi : 10.1093/nar/15.8.3626 . PMC 340760 . PMID 3575107 .
- ^ Beaucage, SL (2001). "2-Cyanoetyltetraisopropylfosforodiamidit". E-EROS Encyclopedia of Reagents for Organic Synthesis . doi : 10.1002/047084289X.rn00312 . ISBN 0471936235 .
- ^ Sinha, ND; Biernat, J.; Koester, H. (1983). "β-Cyanoetyl N,N-dialkylamino/N-morfolinomonoklorfosfoamiditer, nya fosfityleringsmedel som underlättar avskyddning och upparbetning av syntetiserade oligonukleotider". Tetrahedron Lett . 24 (52): 5843–5846. doi : 10.1016/S0040-4039(00)94216-3 .
- ^ Marugg, JE; Burik, A.; Tromp, M.; Van der Marel, GA & Van Boom, JH (1986). "En ny och mångsidig metod för framställning av värdefulla deoxinukleosid 3'-fosfitintermediärer". Tetrahedron Lett . 24 (20): 2271–22274. doi : 10.1016/S0040-4039(00)84506-2 .
- ^ Guzaev, AP; Manoharan, M. (2001). "2-bensamidoetylgrupp - en ny typ av fosfatskyddande grupp för oligonukleotidsyntes". J. Am. Chem. Soc . 123 (5): 783–793. doi : 10.1021/ja0016396 . PMID 11456611 .
- ^ Sproat, B.; Colonna, F.; Mullah, B.; Tsou, D.; Andrus, A.; Hampel, A.; Vinayak, R. (feb 1995). "En effektiv metod för isolering och rening av oligoribonukleotider". Nukleosider och nukleotider . 14 (1&2): 255–273. doi : 10.1080/15257779508014668 . ISSN 0261-3166 .
- ^ Stutz, A.; Hobartner, C.; Pitsch, S. (sep 2000). "Nya fluorid-labila nukleobasskyddande grupper för syntes av 3'(2')-O-aminoacylerade RNA-sekvenser". Helv. Chim. Acta . 83 (9): 2477–2503. doi : 10.1002/1522-2675(20000906)83:9<2477::aid-hlca2477>3.0.co;2-9 . ISSN 0018-019X .
- ^ Welz, R.; Muller, S. (Jan 2002). "5-(Benzylmerkapto)-1H-tetrazol som aktivator för 2'-O-TBDMS fosforamidit byggstenar i RNA-syntes". Tetraederbokstäver . 43 (5): 795–797. doi : 10.1016/S0040-4039(01)02274-2 . ISSN 0040-4039 .
- ^ Vargeese, C.; Carter, J.; Yegge, J.; Krivjansky, S.; Settle, A.; Kropp, E.; Peterson, K.; Pieken, W. (1998). "Effektiv aktivering av nukleosidfosforamiditer med 4,5-dicyanoimidazol under oligonukleotidsyntes" . Nucleic Acids Res . 26 (4): 1046–1050. doi : 10.1093/nar/26.4.1046 . ISSN 0305-1048 . PMC 147346 . PMID 9461466 .
- ^ a b c Gacs-Baitz, E.; Sipos, F.; Egyed, O.; Sagi, G. (2009). "Syntes och strukturell studie av olika oxiderade diastereomera 5'-dimetoxitrityl-tymidin-3'-O-[O-(2-cyanoetyl)-N,N-diisopropyl]-fosforamiditderivat. Jämförelse av effekterna av P=O, P=S och P=Se fungerar på NMR-spektrala och kromatografiska egenskaper". Kiralitet . 21 (7): 663–673. doi : 10.1002/chir.20653 . PMID 18937288 .
- ^ a b Nemer, MJ; Ogilvie, KK (1980). "Fosforamidatanaloger av diribonukleosidmonofosfater". Tetrahedron Lett . 21 (43): 4153–4154. doi : 10.1016/s0040-4039(00)93675-x .
- ^ Wilk, A.; Uznanski, B.; Stec, WJ (1991). "Tilldelning av absolut konfiguration vid fosfor i ditymidylyl(3',5')fosformorfolidater och -fosformorfolidotioater". Nukleosider och nukleotider . 10 (1–3): 319–322. doi : 10.1080/07328319108046469 .
- ^ Guzaev, AP (2011). "Reaktivitet av 3H-1,2,4-ditiazol-3-tioner och 3H-1,2-ditiol-3-tioner som sulfuriseringsmedel för oligonukleotidsyntes". Tetraederbokstäver . 52 (3): 434–437. doi : 10.1016/j.tetlet.2010.11.086 .
- ^ Holloway, GA; Pavot, C.; Scaringe, SA; Lu, Y.; Rauchfuss, TB (2002). "En organometallisk väg till oligonukleotider som innehåller fosforoselenoat". ChemBioChem . 3 (11): 1061-1065. doi : 10.1002/1439-7633(20021104)3:11<1061::aid-cbic1061>3.0.co;2-9 . PMID 12404630 . S2CID 18797616 .
- ^ Ravikumar, VT; Kumar, RK (2004). "Stereoselektiv syntes av alkylfosfonater: en enkel omarrangering av cyanoetylskyddade nukleosidfosforamiditer". Org. Process Res. Dev . 8 (4): 603–608. doi : 10.1021/op030035u .
- ^ "Beta-Cyanoetylfosforamiditer" . Products.appliedbiosystems.com . Hämtad 2009-05-12 .
- ^ "Biosearch Technologies" . Biosearchtech.com . Hämtad 2009-05-12 .
- ^ "ChemGenes Corporation, ett bioteknikföretag" . Chemgenes.com . Hämtad 2009-05-12 .
- ^ M. Powell (2008-01-17). "Applied Biosystems Instruments" . Glenresearch.com . Hämtad 2009-05-12 .
- ^ "Nukleinsyrasyntes & märkning" . Thermo.com. 2008-08-16. Arkiverad från originalet den 28 februari 2009 . Hämtad 2009-05-12 .
- ^ Gryaznov, SM; Letsinger, RL (1991). "Syntes av oligonukleotider via monomerer med oskyddade baser". J. Am. Chem. Soc . 113 (15): 5876–5877. doi : 10.1021/ja00015a059 .
- ^ a b Reddy, MP; Hanna, NB; Farooqui, F. (1997). "Ultrasnabb klyvning och avskyddande av oligonukleotider syntes och användning av C Ac -derivat". Nukleosider och nukleotider . 16 (7–9): 1589–1598. doi : 10.1080/07328319708006236 .
- ^ McMinn, D. (1997). "Syntes av oligonukleotider innehållande 3'-alkylaminer med användning av N-isobutyrylskyddad deoxiadenosinfosforamidit". Tetrahedron Lett . 38 (18): 3123. doi : 10.1016/S0040-4039(97)00568-6 .
- ^ Schulhof, JC; Molko, D.; Teoule, R. (1987). "Det sista avskyddningssteget i oligonukleotidsyntes reduceras till en mild och snabb ammoniakbehandling genom att använda labila basskyddande grupper" . Nucleic Acids Res . 15 (2): 397–416. doi : 10.1093/nar/15.2.397 . PMC 340442 . PMID 3822812 .
- ^ Zhu, Q. (2001). "Observation och eliminering av N-acetylering av oligonukleotider framställda med hjälp av snabbavskyddande fosforamiditer och ultramild avskyddning". Bioorg. Med. Chem. Lett . 11 (9): 1105–7. doi : 10.1016/S0960-894X(01)00161-5 . PMID 11354354 .
- ^ McBride, LJ; Kierzek, R.; Beaucage, SL; Caruthers, MH (1986). "Nukleotidkemi. 16. Amidinskyddande grupper för oligonukleotidsyntes". J. Am. Chem. Soc . 108 (8): 2040. doi : 10.1021/ja00268a052 .
- ^ Sinha, ND; Biernat, J.; McManus, J.; Koester, H. (1984). "Polymerstödjande oligonukleotidsyntes. XVIII: användning av β-cyanoetyl-N,N-dialkylamino-/N-morfolinofosforamidit av deoxinukleosider för syntes av DNA-fragment som förenklar avskyddning och isolering av slutprodukten. " Nucleic Acids Res . 12 (11): 4539–4557. doi : 10.1093/nar/12.11.4539 . PMC 318857 . PMID 6547529 .
- ^ Guzaev, AP; Manoharan, M. (2001). "Fosforamiditkoppling till oligonukleotider som bär oskyddade internukleosidiska fosfatdelar". J. Org. Chem . 66 (5): 1798–1804. doi : 10.1021/jo001591e . PMID 11262130 .
- ^ Ogilvie, KK; Theriault, N.; Sadana, KL (1977). "Syntes av oligoribonukleotider". J. Am. Chem. Soc . 99 (23): 7741–7743. doi : 10.1021/ja00465a073 . PMID 915168 .
- ^ Usman, N.; Ogilvie, KK; Jiang, MY; Cedergren, RJ (1987). "Den automatiserade kemiska syntesen av långa oligoribunkleotider med användning av 2'-O-silylerade ribonukleosid 3'-O-fosforamiditer på ett glasunderlag med kontrollerade porer: syntes av en 43-nukleotidsekvens som liknar 3'-halvmolekylen av en Escherichia coli formylmetion tRNA". J. Am. Chem. Soc . 109 (25): 7845–7854. doi : 10.1021/ja00259a037 .
- ^ Usman, N.; Pon, RT; Ogilvie, KK (1985). "Framställning av ribonukleosid 3'-O-fosforamiditer och deras tillämpning på den automatiserade fastfassyntesen av oligonukleotider". Tetrahedron Lett . 26 (38): 4567–4570. doi : 10.1016/S0040-4039(00)98753-7 .
- ^ Scaringe, SA; Francklyn, C.; Usman, N. (1990). "Kemisk syntes av biologiskt aktiva oligoribonukleotider med användning av β-cyanoetylskyddade ribonukleosidfosforamiditer" . Nucleic Acids Res . 18 (18): 5433–5441. doi : 10.1093/nar/18.18.5433 . PMC 332221 . PMID 2216717 .
- ^ Pitsch, S.; Weiss, PA; Wu, X.; Ackermann, D.; Honegger, T. (1999). "Snabb och pålitlig automatiserad syntes av RNA och delvis 2'-O-skyddade prekursorer ("caged RNA") baserad på två nya, ortogonala 2'-O-skyddande grupper". Helv. Chim. Acta . 82 (10): 1753–1761. doi : 10.1002/(SICI)1522-2675(19991006)82:10<1753::AID-HLCA1753>3.0.CO;2-Y .
- ^ Pitsch, S.; Weiss, PA; Jenny, L.; Stutz, A.; Wu, X. (2001). "Pålitlig kemisk syntes av oligoribonukleotider (RNA) med 2'-O-[(triisopropylsilyl)oxi]metyl(2'-O-tom)-skyddade fosforamiditer". Helv. Chim. Acta . 84 (12): 3773–3795. doi : 10.1002/1522-2675(20011219)84:12<3773::AID-HLCA3773>3.0.CO;2-E .
Vidare läsning
- Comprehensive Natural Products Chemistry, Volym 7: DNA och aspekter av molekylärbiologi. Kool, Eric T.; Redaktör. Neth. (1999), 733 s. Förlag: (Elsevier, Amsterdam, Neth.)
- Beaucage SL, Iyer RP (1992). "Framsteg i syntesen av oligonukleotider genom fosforamiditmetoden" . Tetraeder . 48 (12): 2223–2311. doi : 10.1016/s0040-4020(01)88752-4 .
- Beaucage SL, Iyer RP (1993). "Funktionaliseringen av oligonukleotider via fosforamiditderivat" . Tetraeder . 49 (10): 1925–1963. doi : 10.1016/s0040-4020(01)86295-5 .
- Beaucage SL, Iyer RP (1993). "Syntesen av modifierade oligonukleotider genom fosforamiditmetoden och deras tillämpningar" . Tetraeder . 49 (28): 6123–6194. doi : 10.1016/s0040-4020(01)87958-8 .
- Beaucage, S L. "Oligodeoxiribonukleotider syntes. Fosforamidit tillvägagångssätt. Metoder i molekylärbiologi (Totowa, NJ, USA) (1993), 20 (Protocols for Oligonucleotides and Analogs), 33–61.
- Reese CB (2002). "Den kemiska syntesen av oligo- och polynukleotider: en personlig kommentar". Tetraeder . 58 (44): 8893–8920. doi : 10.1016/s0040-4020(02)01084-0 .
- Brown T., Brown DJS 1991. In Oligonucleotides and Analogues. A Practical Approach, red. F Eckstein, s. 1 – 24. Oxford: IRL