Membranpotential

Membranpotential (även transmembranpotential eller membranspänning ) är skillnaden i elektrisk potential mellan insidan och utsidan av en biologisk cell . Det vill säga, det finns en skillnad i energin som krävs för att elektriska laddningar ska flytta från den inre till den yttre cellulära miljön och vice versa, så länge det inte finns någon insamling av kinetisk energi eller produktion av strålning. Laddningarnas koncentrationsgradienter bestämmer direkt detta energibehov. För utsidan av cellen sträcker sig typiska värden för membranpotential, som normalt anges i enheter av millivolt och betecknas som mV , från –80 mV till –40 mV.
Alla djurceller är omgivna av ett membran som består av ett lipiddubbelskikt med proteiner inbäddade i det. Membranet fungerar både som en isolator och en diffusionsbarriär mot jonernas rörelse . Transmembranproteiner , även kända som jontransporter- eller jonpumpproteiner , driver aktivt joner över membranet och etablerar koncentrationsgradienter över membranet, och jonkanaler tillåter joner att röra sig över membranet nedför dessa koncentrationsgradienter. Jonpumpar och jonkanaler är elektriskt ekvivalenta med en uppsättning batterier och motstånd som är insatta i membranet och skapar därför en spänning mellan membranets två sidor.
Nästan alla plasmamembran har en elektrisk potential över sig, med insidan vanligtvis negativ med avseende på utsidan. Membranpotentialen har två grundläggande funktioner. För det första tillåter det en cell att fungera som ett batteri, vilket ger kraft att driva en mängd olika "molekylära enheter" inbäddade i membranet. För det andra, i elektriskt exciterbara celler som neuroner och muskelceller , används det för att överföra signaler mellan olika delar av en cell. Signaler genereras genom öppning eller stängning av jonkanaler vid en punkt i membranet, vilket ger en lokal förändring i membranpotentialen. Denna förändring i det elektriska fältet kan snabbt avkännas av antingen intilliggande eller mer avlägsna jonkanaler i membranet. Dessa jonkanaler kan sedan öppnas eller stängas som ett resultat av den potentiella förändringen och reproducera signalen.
I icke-exciterbara celler och i exciterbara celler i deras baslinjetillstånd hålls membranpotentialen vid ett relativt stabilt värde, kallat vilopotentialen . För neuroner definieras vilopotential som sträcker sig från –80 till –70 millivolt; det vill säga det inre av en cell har en negativ baslinjespänning på lite mindre än en tiondels volt. Öppning och stängning av jonkanaler kan inducera ett avsteg från vilopotentialen. Detta kallas en depolarisering om den inre spänningen blir mindre negativ (säg från –70 mV till –60 mV), eller en hyperpolarisering om den inre spänningen blir mer negativ (säg från –70 mV till –80 mV). I exciterbara celler kan en tillräckligt stor depolarisering framkalla en aktionspotential , där membranpotentialen ändras snabbt och signifikant under en kort tid (i storleksordningen 1 till 100 millisekunder), ofta vänder dess polaritet. Aktionspotentialer genereras genom aktivering av vissa spänningsstyrda jonkanaler .
I neuroner är faktorerna som påverkar membranpotentialen olika. De inkluderar ett flertal typer av jonkanaler, av vilka några är kemiskt grindade och några är spänningsstyrda. Eftersom spänningsstyrda jonkanaler styrs av membranpotentialen, medan själva membranpotentialen påverkas av samma jonkanaler, uppstår återkopplingsslingor som tillåter komplex tidsdynamik, inklusive oscillationer och regenerativa händelser såsom aktionspotentialer.
Fysisk grund
Membranpotentialen i en cell härrör i slutändan från två faktorer: elektrisk kraft och diffusion. Elektrisk kraft uppstår från den ömsesidiga attraktionen mellan partiklar med motsatta elektriska laddningar (positiva och negativa) och den ömsesidiga repulsionen mellan partiklar med samma typ av laddning (båda positiva eller båda negativa). Diffusion uppstår från den statistiska tendensen hos partiklar att omfördelas från regioner där de är mycket koncentrerade till regioner där koncentrationen är låg.
Spänning
Spänning, som är synonymt med skillnad i elektrisk potential , är förmågan att driva en elektrisk ström över ett motstånd. Den enklaste definitionen av en spänning ges faktiskt av Ohms lag : V=IR, där V är spänning, I är ström och R är resistans. Om en spänningskälla som ett batteri placeras i en elektrisk krets, ju högre spänning källan har, desto större mängd ström kommer den att driva över det tillgängliga motståndet. Spänningens funktionella betydelse ligger endast i potentialskillnader mellan två punkter i en krets. Tanken på en spänning vid en enda punkt är meningslös. Det är konventionellt inom elektroniken att tilldela en spänning på noll till något godtyckligt valt element i kretsen, och sedan tilldela spänningar för andra element uppmätta i förhållande till den nollpunkten. Det finns ingen betydelse i vilket element som väljs som nollpunkt - funktionen hos en krets beror bara på skillnaderna inte på spänningar i sig . Men i de flesta fall och enligt konvention tilldelas nollnivån oftast den del av en krets som är i kontakt med jord.
Samma princip gäller för spänning i cellbiologi. I elektriskt aktiv vävnad kan potentialskillnaden mellan två valfria punkter mätas genom att sätta in en elektrod vid varje punkt, till exempel en inuti och en utanför cellen, och ansluta båda elektroderna till ledningarna på vad som i huvudsak är en specialiserad voltmeter. Enligt konvention tilldelas nollpotentialvärdet till utsidan av cellen och tecknet för potentialskillnaden mellan utsidan och insidan bestäms av potentialen hos insidan i förhållande till utsidans noll.
I matematiska termer börjar definitionen av spänning med begreppet ett elektriskt fält E , ett vektorfält som tilldelar en storlek och riktning till varje punkt i rymden. I många situationer är det elektriska fältet ett konservativt fält , vilket betyder att det kan uttryckas som gradienten för en skalär funktion V , det vill säga E = –∇ V . Detta skalära fält V kallas spänningsfördelningen. Definitionen tillåter en godtycklig integrationskonstant - det är därför absoluta spänningsvärden inte är meningsfulla. Generellt sett kan elektriska fält behandlas som konservativa endast om magnetiska fält inte nämnvärt påverkar dem, men detta tillstånd gäller vanligtvis väl för biologisk vävnad.
Eftersom det elektriska fältet är gradienten av spänningsfördelningen, innebär snabba förändringar i spänningen inom en liten region ett starkt elektriskt fält; omvänt, om spänningen förblir ungefär densamma över ett stort område, måste de elektriska fälten i den regionen vara svaga. Ett starkt elektriskt fält, motsvarande en stark spänningsgradient, innebär att en stark kraft utövas på alla laddade partiklar som ligger inom området.
Joner och krafterna som driver deras rörelse

Elektriska signaler inom biologiska organismer drivs i allmänhet av joner . De viktigaste katjonerna för aktionspotentialen är natrium (Na + ) och kalium (K + ). Båda dessa är monovalenta katjoner som bär en enda positiv laddning. Aktionspotentialer kan också involvera kalcium (Ca 2+ ), som är en tvåvärd katjon som bär en dubbel positiv laddning. Kloridanjonen (Cl − ) spelar en stor roll i aktionspotentialen hos vissa alger , men spelar en försumbar roll i aktionspotentialen hos de flesta djur .
Joner passerar cellmembranet under två influenser: diffusion och elektriska fält . Ett enkelt exempel där två lösningar - A och B - är åtskilda av en porös barriär illustrerar att diffusion kommer att säkerställa att de så småningom kommer att blandas till lika lösningar. Denna blandning sker på grund av skillnaden i deras koncentrationer. Området med hög koncentration kommer att diffundera ut mot området med låg koncentration. För att utöka exemplet, låt lösning A ha 30 natriumjoner och 30 kloridjoner. Låt också lösning B bara ha 20 natriumjoner och 20 kloridjoner. Om man antar att barriären tillåter båda typerna av joner att färdas genom den, kommer ett stabilt tillstånd att uppnås där båda lösningarna har 25 natriumjoner och 25 kloridjoner. Om emellertid den porösa barriären är selektiv för vilken joner släpps igenom, kommer diffusion ensam inte att bestämma den resulterande lösningen. För att återgå till det tidigare exemplet, låt oss nu konstruera en barriär som endast är genomsläpplig för natriumjoner. Nu tillåts bara natrium att diffundera över barriären från dess högre koncentration i lösning A till den lägre koncentrationen i lösning B. Detta kommer att resultera i en större ansamling av natriumjoner än kloridjoner i lösning B och ett mindre antal natriumjoner än kloridjoner i lösning A.
Detta betyder att det finns en positiv nettoladdning i lösning B från den högre koncentrationen av positivt laddade natriumjoner än negativt laddade kloridjoner. Likaså finns det en negativ nettoladdning i lösning A från den större koncentrationen av negativa kloridjoner än positiva natriumjoner. Eftersom motsatta laddningar attraherar och liknande laddningar stöter bort, påverkas jonerna nu också av elektriska fält såväl som diffusionskrafter. Därför kommer positiva natriumjoner att vara mindre benägna att resa till den nu-mer-positiva B-lösningen och förbli i den nu-mer-negativa A-lösningen. Den punkt där krafterna i de elektriska fälten helt motverkar kraften på grund av diffusion kallas för jämviktspotential. Vid denna tidpunkt är nettoflödet av den specifika jonen (i detta fall natrium) noll.
Plasmamembran

Varje cell är innesluten i ett plasmamembran , som har strukturen av ett lipiddubbelskikt med många typer av stora molekyler inbäddade i det. Eftersom det är gjort av lipidmolekyler har plasmamembranet i sig en hög elektrisk resistivitet, med andra ord en låg inneboende permeabilitet för joner. Men några av molekylerna inbäddade i membranet kan antingen aktivt transportera joner från ena sidan av membranet till den andra eller tillhandahålla kanaler genom vilka de kan röra sig.
I elektrisk terminologi fungerar plasmamembranet som ett kombinerat motstånd och kondensator . Motstånd uppstår från det faktum att membranet hindrar rörelsen av laddningar över det. Kapacitans uppstår av att lipiddubbelskiktet är så tunt att en ansamling av laddade partiklar på ena sidan ger upphov till en elektrisk kraft som drar motsatt laddade partiklar mot den andra sidan. Membranets kapacitans är relativt opåverkad av molekylerna som är inbäddade i det, så det har ett mer eller mindre invariant värde uppskattat till 2 μF/cm 2 (den totala kapacitansen för en membranlapp är proportionell mot dess area). Konduktansen hos ett rent lipiddubbelskikt är å andra sidan så låg att den i biologiska situationer alltid domineras av konduktansen hos alternativa vägar som tillhandahålls av inbäddade molekyler. Således är membranets kapacitans mer eller mindre fixerad, men motståndet är mycket variabelt.
Tjockleken på ett plasmamembran uppskattas till cirka 7-8 nanometer. Eftersom membranet är så tunt krävs det inte en mycket stor transmembranspänning för att skapa ett starkt elektriskt fält inom det. Typiska membranpotentialer i djurceller är i storleksordningen 100 millivolt (det vill säga en tiondels volt), men beräkningar visar att detta genererar ett elektriskt fält nära det maximala som membranet kan upprätthålla – det har beräknats att en spänning En skillnad som är mycket större än 200 millivolt kan orsaka dielektriskt sammanbrott , det vill säga bågbildning över membranet.
Underlättat diffusion och transport

Motståndet hos ett rent lipiddubbelskikt mot passage av joner över det är mycket högt, men strukturer inbäddade i membranet kan kraftigt förbättra jonrörelsen, antingen aktivt eller passivt , via mekanismer som kallas underlättad transport och underlättad diffusion . De två typerna av strukturer som spelar de största rollerna är jonkanaler och jonpumpar , båda vanligtvis bildade av sammansättningar av proteinmolekyler. Jonkanaler tillhandahåller passager genom vilka joner kan röra sig. I de flesta fall är en jonkanal permeabel endast för specifika typer av joner (till exempel natrium och kalium men inte klorid eller kalcium), och ibland varierar permeabiliteten beroende på jonernas rörelseriktning. Jonpumpar, även kända som jontransportörer eller bärarproteiner, transporterar aktivt specifika typer av joner från ena sidan av membranet till den andra, ibland använder energi som härrör från metaboliska processer för att göra det.
Jonpumpar
Jonpumpar är integrerade membranproteiner som utför aktiv transport , dvs. använder cellulär energi (ATP) för att "pumpa" jonerna mot deras koncentrationsgradient. Sådana jonpumpar tar in joner från ena sidan av membranet (minskar dess koncentration där) och släpper ut dem på andra sidan (ökar dess koncentration där).
Den jonpump som är mest relevant för aktionspotentialen är natrium-kalium-pumpen , som transporterar tre natriumjoner ut ur cellen och två kaliumjoner in. Som en konsekvens är koncentrationen av kaliumjoner K + inuti neuronen ungefär 20-faldig större än den yttre koncentrationen, medan natriumkoncentrationen utanför är ungefär nio gånger större än inuti. På liknande sätt har andra joner olika koncentrationer inuti och utanför neuronen, såsom kalcium , klorid och magnesium .
Om antalet för varje typ av jon var lika, skulle natrium-kalium-pumpen vara elektriskt neutral, men på grund av tre-för-två-utbytet ger den en nettorörelse av en positiv laddning från intracellulär till extracellulär för varje cykel, vilket bidrar till en positiv spänningsskillnad. Pumpen har tre effekter: (1) den gör natriumkoncentrationen hög i det extracellulära utrymmet och låg i det intracellulära utrymmet; (2) det gör kaliumkoncentrationen hög i det intracellulära utrymmet och låg i det extracellulära utrymmet; (3) det ger det intracellulära utrymmet en negativ spänning i förhållande till det extracellulära utrymmet.
Natrium-kaliumpumpen är relativt långsam i drift. Om en cell initierades med lika koncentrationer av natrium och kalium överallt, skulle det ta timmar för pumpen att etablera jämvikt. Pumpen arbetar konstant, men blir allt mindre effektiv eftersom koncentrationerna av natrium och kalium som är tillgängliga för pumpning minskar.
Jonpumpar påverkar aktionspotentialen endast genom att fastställa det relativa förhållandet mellan intracellulära och extracellulära jonkoncentrationer. Aktionspotentialen innebär huvudsakligen öppning och stängning av jonkanaler, inte jonpumpar. Om jonpumparna stängs av genom att ta bort sin energikälla, eller genom att lägga till en hämmare som ouabain , kan axonet fortfarande avfyra hundratusentals aktionspotentialer innan deras amplituder börjar avta markant. I synnerhet spelar jonpumpar ingen signifikant roll i repolariseringen av membranet efter en aktionspotential.
En annan funktionellt viktig jonpump är natrium-kalciumväxlaren . Denna pump fungerar på ett konceptuellt sätt liknande natrium-kalium-pumpen, förutom att den i varje cykel byter ut tre Na + från det extracellulära utrymmet mot en Ca ++ från det intracellulära utrymmet. Eftersom nettoflödet av laddning är inåt, går denna pump "nedför", i själva verket, och kräver därför ingen energikälla förutom membranspänningen. Dess viktigaste effekt är att pumpa kalcium utåt - det tillåter också ett inåtflöde av natrium, vilket motverkar natrium-kalium-pumpen, men eftersom de totala natrium- och kaliumkoncentrationerna är mycket högre än kalciumkoncentrationerna är denna effekt relativt oviktig. Nettoresultatet av natrium-kalciumbytaren är att i vilotillstånd blir intracellulära kalciumkoncentrationer mycket låga.
Jonkanaler
Jonkanaler är integrerade membranproteiner med en por genom vilken joner kan färdas mellan extracellulärt utrymme och cellens inre. De flesta kanaler är specifika (selektiva) för en jon; till exempel kännetecknas de flesta kaliumkanaler av ett selektivitetsförhållande på 1000:1 för kalium framför natrium, även om kalium- och natriumjoner har samma laddning och skiljer sig endast något i radien. Kanalporen är vanligtvis så liten att joner måste passera genom den i en filordning. Kanalporer kan vara antingen öppna eller stängda för jonpassage, även om ett antal kanaler uppvisar olika subkonduktansnivåer. När en kanal är öppen, tränger joner genom kanalporen ner genom transmembrankoncentrationsgradienten för just den jonen. Hastigheten för jonflöde genom kanalen, dvs enkanals strömamplitud, bestäms av den maximala kanalkonduktansen och den elektrokemiska drivkraften för den jonen, vilket är skillnaden mellan det momentana värdet på membranpotentialen och värdet på omkastningspotentialen .
En kanal kan ha flera olika tillstånd (motsvarande olika konformationer av proteinet), men varje sådant tillstånd är antingen öppet eller stängt. I allmänhet motsvarar stängda tillstånd antingen en sammandragning av poren - vilket gör den oförgänglig för jonen - eller en separat del av proteinet, vilket stoppar poren. Till exempel genomgår den spänningsberoende natriumkanalen inaktivering , där en del av proteinet svänger in i poren och förseglar den. Denna inaktivering stänger av natriumströmmen och spelar en avgörande roll i aktionspotentialen.
Jonkanaler kan klassificeras efter hur de reagerar på sin omgivning. Till exempel är jonkanalerna involverade i aktionspotentialen spänningskänsliga kanaler ; de öppnas och stängs som svar på spänningen över membranet. Ligand-gated kanaler bildar en annan viktig klass; dessa jonkanaler öppnas och stängs som svar på bindningen av en ligandmolekyl , såsom en neurotransmittor . Andra jonkanaler öppnas och stängs med mekaniska krafter. Ännu andra jonkanaler - såsom de hos sensoriska neuroner - öppnas och stängs som svar på andra stimuli, såsom ljus, temperatur eller tryck.
Läckagekanaler
Läckagekanaler är den enklaste typen av jonkanal, eftersom deras permeabilitet är mer eller mindre konstant. De typer av läckagekanaler som har störst betydelse i neuroner är kalium- och kloridkanaler. Även dessa är inte helt konstanta i sina egenskaper: För det första är de flesta av dem spänningsberoende i den meningen att de leder bättre i en riktning än den andra (med andra ord, de är likriktare ); för det andra kan vissa av dem stängas av av kemiska ligander även om de inte kräver ligander för att fungera.
Ligand-gated kanaler
Ligandstyrda jonkanaler är kanaler vars permeabilitet ökar kraftigt när någon typ av kemisk ligand binder till proteinstrukturen. Djurceller innehåller hundratals, om inte tusentals, typer av dessa. En stor delmängd fungerar som neurotransmittorreceptorer - de förekommer på postsynaptiska platser, och den kemiska liganden som portar dem frisätts av den presynaptiska axonterminalen . Ett exempel på denna typ är AMPA-receptorn , en receptor för signalsubstansen glutamat som när den aktiveras tillåter passage av natrium- och kaliumjoner. Ett annat exempel är GABAA- receptorn , en receptor för signalsubstansen GABA som när den aktiveras tillåter passage av kloridjoner.
Neurotransmittorreceptorer aktiveras av ligander som uppträder i det extracellulära området, men det finns andra typer av ligandstyrda kanaler som styrs av interaktioner på den intracellulära sidan.
Spänningsberoende kanaler
Spänningsstyrda jonkanaler , även kända som spänningsberoende jonkanaler , är kanaler vars permeabilitet påverkas av membranpotentialen. De bildar en annan mycket stor grupp, där varje medlem har en speciell jonselektivitet och ett speciellt spänningsberoende. Många är också tidsberoende — med andra ord, de reagerar inte direkt på en spänningsförändring utan först efter en fördröjning.
En av de viktigaste medlemmarna i denna grupp är en typ av spänningsstyrd natriumkanal som ligger till grund för aktionspotentialer - dessa kallas ibland Hodgkin-Huxley natriumkanaler eftersom de ursprungligen karaktäriserades av Alan Lloyd Hodgkin och Andrew Huxley i deras Nobelprisbelönta studier av aktionspotentialens fysiologi. Kanalen stängs vid vilospänningsnivån, men öppnas abrupt när spänningen överstiger en viss tröskel, vilket tillåter ett stort inflöde av natriumjoner som ger en mycket snabb förändring av membranpotentialen. Återhämtning från en aktionspotential är delvis beroende av en typ av spänningsstyrd kaliumkanal som är stängd vid vilospänningsnivån men öppnar sig som en konsekvens av den stora spänningsförändring som uppstår under aktionspotentialen.
Reverseringspotential
Omkastningspotentialen (eller jämviktspotentialen ) för en jon är värdet på transmembranspänningen vid vilken diffusiva och elektriska krafter motverkar, så att det inte finns något nettojonflöde över membranet . Detta betyder att transmembranspänningen exakt motverkar diffusionskraften hos jonen, så att jonens nettoström över membranet är noll och oföränderlig. Omkastningspotentialen är viktig eftersom den ger spänningen som verkar på kanaler som är genomsläppliga för den jonen - med andra ord, den ger spänningen som jonkoncentrationsgradienten genererar när den fungerar som ett batteri .
Jämviktspotentialen för en viss jon betecknas vanligtvis med beteckningen E -jon . Jämviktspotentialen för en jon kan beräknas med hjälp av Nernst-ekvationen . Till exempel kommer reverseringspotentialen för kaliumjoner att vara följande:
var
- E eq,K + är jämviktspotentialen för kalium, mätt i volt
- R är den universella gaskonstanten , lika med 8,314 joule ·K −1 ·mol −1
- T är den absoluta temperaturen , mätt i kelvin (= K = grader Celsius + 273,15)
- z är antalet elementära laddningar av jonen i fråga som är involverad i reaktionen
- F är Faradays konstant , lika med 96 485 coulombs ·mol −1 eller J·V −1 ·mol −1
- [K + ] o är den extracellulära koncentrationen av kalium, mätt i mol ·m −3 eller mmol·l −1
- [K + ] i är den intracellulära koncentrationen av kalium
Även om två olika joner har samma laddning (dvs. K + och Na + ), kan de fortfarande ha väldigt olika jämviktspotentialer, förutsatt att deras yttre och/eller inre koncentrationer skiljer sig åt. Ta till exempel jämviktspotentialerna för kalium och natrium i neuroner. Kaliumjämviktspotentialen E K är -84 mV med 5 mM kalium utanför och 140 mM inuti. Å andra sidan är natriumjämviktspotentialen, E Na , ungefär +66 mV med ungefär 12 mM natrium inuti och 140 mM utanför.
Förändringar av membranpotential under utveckling
En neurons vilande membranpotential förändras faktiskt under utvecklingen av en organism. För att en neuron så småningom ska anta sin fulla vuxenfunktion måste dess potential regleras hårt under utvecklingen. När en organism fortskrider genom utvecklingen blir vilomembranpotentialen mer negativ. Gliaceller differentierar sig också och förökar sig när utvecklingen fortskrider i hjärnan . Tillsatsen av dessa gliaceller ökar organismens förmåga att reglera extracellulärt kalium . Minskningen av extracellulärt kalium kan leda till en minskning av membranpotentialen på 35 mV.
Cellexcitabilitet
Cellexcitabilitet är förändringen i membranpotential som är nödvändig för cellulära svar i olika vävnader. Cellexcitabilitet är en egenskap som induceras under tidig embriogenes. En cells excitabilitet har också definierats som den lätthet med vilken ett svar kan utlösas. Vilo- och tröskelpotentialen utgör grunden för cellexcitabilitet och dessa processer är grundläggande för genereringen av graderade och aktionspotentialer.
De viktigaste regulatorerna för cellexcitabilitet är de extracellulära elektrolytkoncentrationerna (dvs Na + , K + , Ca 2+ , Cl − , Mg 2+ ) och associerade proteiner. Viktiga proteiner som reglerar cellens excitabilitet är spänningsstyrda jonkanaler , jontransportörer (t.ex. Na+/K+-ATPas , magnesiumtransportörer , syra-bastransportörer ), membranreceptorer och hyperpolarisationsaktiverade cykliska nukleotidstyrda kanaler . Till exempel kaliumkanaler och kalciumavkännande receptorer viktiga regulatorer av excitabilitet i neuroner , hjärtmyocyter och många andra exciterbara celler som astrocyter . Kalciumjon är också den viktigaste andra budbäraren i signalering av exciterbara celler . Aktivering av synaptiska receptorer initierar långvariga förändringar i neuronal excitabilitet. Sköldkörtel- , binjure- och andra hormoner reglerar också cellernas excitabilitet, till exempel modulerar progesteron och östrogen myometriella glatta muskelcellers excitabilitet.
Många celltyper anses ha ett exciterbart membran. Excitabla celler är neuroner, myocyter (hjärt-, skelett-, släta ), vaskulära endotelceller , pericyter , juxtaglomerulära celler , interstitialceller från Cajal , många typer av epitelceller (t.ex. betaceller , alfaceller , deltaceller , enteroendokrina celler , neuroendokrina celler , pinealocyter ), gliaceller (t.ex. astrocyter), mekanoreceptorceller (t.ex. hårceller och Merkelceller ), kemoreceptorceller (t.ex. glomusceller , smakreceptorer ), vissa växtceller och möjligen immunceller . Astrocyter uppvisar en form av icke-elektrisk excitabilitet baserad på intracellulära kalciumvariationer relaterade till uttrycket av flera receptorer genom vilka de kan detektera den synaptiska signalen. I neuroner finns det olika membranegenskaper i vissa delar av cellen, till exempel ger dendritisk excitabilitet neuroner kapacitet för tillfällighetsdetektering av rumsligt separerade ingångar.
Ekvivalent krets
Elektrofysiologer modellerar effekterna av jonkoncentrationsskillnader, jonkanaler och membrankapacitans i termer av en ekvivalent krets , som är avsedd att representera de elektriska egenskaperna hos en liten membranfläck. Den ekvivalenta kretsen består av en kondensator parallellt med fyra banor som var och en består av ett batteri i serie med variabel konduktans. Kapacitansen bestäms av egenskaperna hos lipiddubbelskiktet och anses vara fixerad. Var och en av de fyra parallella vägarna kommer från en av de viktigaste jonerna, natrium, kalium, klorid och kalcium. Spänningen för varje jonbana bestäms av jonkoncentrationerna på varje sida av membranet; se Återföringspotential ovan. Konduktansen för varje jonväg vid vilken tidpunkt som helst bestäms av tillstånden för alla jonkanaler som är potentiellt permeabla för den jonen, inklusive läckkanaler, ligandstyrda kanaler och spänningsstyrda jonkanaler.

För fasta jonkoncentrationer och fasta värden på jonkanalkonduktans kan den ekvivalenta kretsen reduceras ytterligare, med hjälp av Goldman-ekvationen som beskrivs nedan, till en krets som innehåller en kapacitans parallell med ett batteri och konduktans. I elektriska termer är detta en typ av RC-krets (resistans-kapacitanskrets), och dess elektriska egenskaper är mycket enkla. Utgående från vilket initialt tillstånd som helst, avtar strömmen som flyter över antingen konduktansen eller kapacitansen med ett exponentiellt tidsförlopp, med en tidskonstant på τ = RC , där C är kapacitansen för membranlappen och R = 1/g netto är nettomotståndet. För realistiska situationer ligger tidskonstanten vanligtvis i intervallet 1—100 millisekunder. I de flesta fall sker förändringar i konduktansen hos jonkanaler på en snabbare tidsskala, så en RC-krets är inte en bra approximation; emellertid är differentialekvationen som används för att modellera en membranlapp vanligtvis en modifierad version av RC-kretsekvationen.
Vilande potential
När membranpotentialen i en cell går under en lång tid utan att förändras nämnvärt, kallas det en vilopotential eller vilospänning. Denna term används för membranpotentialen för icke-exciterbara celler, men också för membranpotentialen för exciterbara celler i frånvaro av excitation. I exciterbara celler är de andra möjliga tillstånden graderade membranpotentialer (av variabel amplitud), och aktionspotentialer, som är stora, allt-eller-inget stiger i membranpotential som vanligtvis följer ett fast tidsförlopp. Excitabla celler inkluderar neuroner , muskelceller och vissa sekretoriska celler i körtlar . Även i andra typer av celler kan emellertid membranspänningen genomgå förändringar som svar på miljö- eller intracellulära stimuli. Till exempel verkar depolarisering av plasmamembranet vara ett viktigt steg i programmerad celldöd .
Interaktionerna som genererar vilopotentialen modelleras av Goldman-ekvationen . Detta liknar i form av Nernst-ekvationen som visas ovan, genom att den är baserad på laddningarna av jonerna i fråga, såväl som skillnaden mellan deras inre och yttre koncentrationer. Den tar emellertid också hänsyn till plasmamembranets relativa permeabilitet för varje jon i fråga.
De tre jonerna som förekommer i denna ekvation är kalium (K + ), natrium (Na + ) och klorid (Cl − ). Kalcium utelämnas, men kan tillsättas för att hantera situationer där det spelar en betydande roll. Eftersom det är en anjon, behandlas kloridtermerna annorlunda än katjontermerna; den intracellulära koncentrationen är i täljaren och den extracellulära koncentrationen i nämnaren, som är omvänd från katjontermerna. Pi står för den relativa permeabiliteten för jontypen i.
I huvudsak uttrycker Goldman-formeln membranpotentialen som ett vägt medelvärde av reverseringspotentialerna för de individuella jontyperna, viktat efter permeabilitet. (Även om membranpotentialen ändras cirka 100 mV under en aktionspotential, ändras inte koncentrationerna av joner i och utanför cellen nämnvärt. De förblir nära sina respektive koncentrationer när membranet har vilopotential.) I de flesta djurceller, permeabiliteten för kalium är mycket högre i vila än permeabiliteten för natrium. Som en konsekvens är vilopotentialen vanligtvis nära kaliumreverseringspotentialen. Permeabiliteten för klorid kan vara tillräckligt hög för att vara signifikant, men till skillnad från de andra jonerna pumpas klorid inte aktivt och därför utjämnas vid en omkastningspotential mycket nära vilopotentialen som bestäms av de andra jonerna.
Värden på vilande membranpotential i de flesta djurceller varierar vanligtvis mellan kaliumomkastningspotentialen (vanligtvis runt -80 mV) och runt -40 mV. Vilopotentialen i exciterbara celler (som kan producera aktionspotentialer) är vanligtvis nära -60 mV - mer depolariserade spänningar skulle leda till spontan generering av aktionspotentialer. Omogna eller odifferentierade celler visar mycket varierande värden på vilospänning, vanligtvis betydligt mer positiva än i differentierade celler. I sådana celler korrelerar vilopotentialvärdet med graden av differentiering: odifferentierade celler kan i vissa fall inte visa någon transmembranspänningsskillnad alls.
Att underhålla vilopotentialen kan vara metaboliskt kostsamt för en cell på grund av dess krav på aktiv pumpning av joner för att motverka förluster på grund av läckagekanaler. Kostnaden är högst när cellfunktionen kräver ett särskilt depolariserat värde på membranspänningen. Till exempel kan vilopotentialen i dagsljus-anpassade spyfluga ( Caliphora vicina ) fotoreceptorer vara så hög som -30 mV. Denna förhöjda membranpotential tillåter cellerna att reagera mycket snabbt på visuella input; kostnaden är att underhåll av vilopotentialen kan konsumera mer än 20 % av den totala cellulära ATP .
Å andra sidan medför den höga vilopotentialen i odifferentierade celler inte nödvändigtvis en hög metabolisk kostnad. Denna skenbara paradox löses genom att undersöka ursprunget till denna vilapotential. Litet differentierade celler kännetecknas av extremt hög ingångsresistans, vilket innebär att få läckagekanaler finns närvarande i detta skede av cellliv. Som ett uppenbart resultat blir kaliumpermeabiliteten liknande den för natriumjoner, vilket placerar vilopotentialen mellan reverseringspotentialerna för natrium och kalium som diskuterats ovan. De minskade läckströmmarna innebär också att det finns lite behov av aktiv pumpning för att kompensera, därför låg metabolisk kostnad.
Graderade potentialer
Som förklarats ovan bestäms potentialen vid vilken punkt som helst i en cells membran av jonkoncentrationsskillnaderna mellan de intracellulära och extracellulära områdena och av membranets permeabilitet för varje typ av jon. Jonkoncentrationerna förändras normalt inte särskilt snabbt (med undantag för Ca 2+ , där den intracellulära baslinjekoncentrationen är så låg att även ett litet inflöde kan öka den i storleksordningar), men jonernas permeabiliteter kan förändras i en bråkdel av en millisekund, som ett resultat av aktivering av ligandstyrda jonkanaler. Förändringen i membranpotential kan vara antingen stor eller liten, beroende på hur många jonkanaler som är aktiverade och vilken typ de är, och kan vara antingen långa eller korta, beroende på hur länge kanalerna förblir öppna. Förändringar av denna typ kallas graderade potentialer , i motsats till aktionspotentialer, som har en fast amplitud och tidsförlopp.
Såsom kan härledas från Goldman-ekvationen som visas ovan, förskjuter effekten av att öka permeabiliteten för ett membran för en viss typ av jon membranpotentialen mot omkastningspotentialen för den jonen. Öppnande av Na + -kanaler förskjuter således membranpotentialen mot Na + -omkastningspotentialen, som vanligtvis är runt +100 mV. På samma sätt skiftar öppning av K + -kanaler membranpotentialen mot cirka –90 mV, och öppning av Cl - kanaler skiftar den mot cirka –70 mV (vilopotential för de flesta membran). Sålunda förskjuter Na + -kanaler membranpotentialen i positiv riktning, K + -kanaler förskjuter den i negativ riktning (förutom när membranet är hyperpolariserat till ett värde som är mer negativt än K + -omkastningspotentialen), och Cl - kanaler tenderar att förskjutas det mot vilopotentialen.
Graderade membranpotentialer är särskilt viktiga i neuroner , där de produceras av synapser - en tillfällig förändring i membranpotential som produceras genom aktivering av en synaps av en enda graderad eller aktionspotential kallas en postsynaptisk potential . Neurotransmittorer som verkar för att öppna Na + -kanaler orsakar vanligtvis att membranpotentialen blir mer positiv, medan neurotransmittorer som aktiverar K + -kanaler vanligtvis gör att den blir mer negativ; de som hämmar dessa kanaler tenderar att ha motsatt effekt.
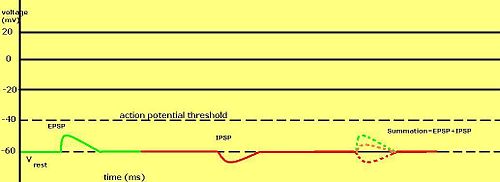
Huruvida en postsynaptisk potential anses excitatorisk eller hämmande beror på omkastningspotentialen för jonerna i den strömmen och tröskeln för cellen att avfyra en aktionspotential (cirka –50mV). En postsynaptisk ström med en omkastningspotential över tröskelvärdet, såsom en typisk Na + -ström, anses excitatorisk. En ström med en omkastningspotential under tröskelvärdet, såsom en typisk K + -ström, anses hämmande. En ström med en omkastningspotential över vilopotentialen, men under tröskelvärdet, kommer inte i sig själv att framkalla aktionspotentialer, utan kommer att producera subtröskelmembranpotentialoscillationer . Således producerar neurotransmittorer som verkar för att öppna Na + -kanaler excitatoriska postsynaptiska potentialer , eller EPSPs, medan neurotransmittorer som verkar för att öppna K + - eller Cl - kanaler vanligtvis producerar hämmande postsynaptiska potentialer , eller IPSPs. När flera typer av kanaler är öppna inom samma tidsperiod, summeras deras postsynaptiska potentialer (läggs ihop).
Andra värden
Ur biofysikens synvinkel är vilomembranpotentialen bara membranpotentialen som är resultatet av membranpermeabiliteterna som dominerar när cellen vilar. Ovanstående ekvation av vägda medelvärden gäller alltid, men följande tillvägagångssätt kan vara lättare att visualisera. Vid varje givet ögonblick finns det två faktorer för en jon som avgör hur mycket inflytande den jonen kommer att ha över en cells membranpotential:
- Den jonens drivkraft
- Den jonens permeabilitet
Om drivkraften är hög, så "skjuts" jonen över membranet. Om permeabiliteten är hög blir det lättare för jonen att diffundera över membranet.
- Drivkraft är den elektriska nettokraft som är tillgänglig för att flytta den jonen över membranet. Den beräknas som skillnaden mellan den spänning som jonen "vill" vara på (sin jämviktspotential) och den faktiska membranpotentialen ( Em ). Så formellt sett är drivkraften för en jon = E m - E -jon
- Till exempel, vid vår tidigare beräknade vilopotential på −73 mV, är drivkraften på kalium 7 mV : (−73 mV) − (−80 mV) = 7 mV. Drivkraften på natrium skulle vara (−73 mV) − (60 mV) = −133 mV.
- Permeabilitet är ett mått på hur lätt en jon kan passera membranet. Den mäts normalt som den (elektriska) konduktansen och enheten, siemens , motsvarar 1 C·s −1 ·V −1 , det vill säga en coulomb per sekund per volt potential.
Så, i ett vilande membran, medan drivkraften för kalium är låg, är dess permeabilitet mycket hög. Natrium har en enorm drivkraft men nästan ingen vilopermeabilitet. I det här fallet bär kalium cirka 20 gånger mer ström än natrium och har därmed 20 gånger mer inflytande över E m än vad natrium har.
Men överväg ett annat fall - toppen av handlingspotentialen. Här är permeabiliteten för Na hög och K-permeabiliteten relativt låg. Således rör sig membranet till nära E Na och långt från E K .
Ju fler joner som är genomträngande desto mer komplicerat blir det att förutsäga membranpotentialen. Detta kan dock göras med hjälp av Goldman-Hodgkin-Katz-ekvationen eller den viktade medelekvationen. Genom att plugga in koncentrationsgradienterna och jonernas permeabiliteter vid vilket ögonblick som helst, kan man bestämma membranpotentialen i det ögonblicket. Vad GHK-ekvationerna betyder är att värdet på membranpotentialen när som helst kommer att vara ett vägt medelvärde av jämviktspotentialerna för alla permeanta joner. "Viktningen" är jonernas relativa permeabilitet över membranet.
Effekter och konsekvenser
Medan celler förbrukar energi för att transportera joner och etablera en transmembranpotential, använder de denna potential i sin tur för att transportera andra joner och metaboliter som socker. Mitokondriernas transmembranpotential driver produktionen av ATP , som är den gemensamma valutan för biologisk energi.
Celler kan dra på energin de lagrar i vilopotentialen för att driva aktionspotentialer eller andra former av excitation. Dessa förändringar i membranpotentialen möjliggör kommunikation med andra celler (som med aktionspotentialer) eller initierar förändringar inuti cellen, vilket sker i ett ägg när det befruktas av en spermie .
Förändringar i plasmamembranets dielektriska egenskaper kan fungera som kännetecken för underliggande tillstånd som diabetes och dyslipidemi.
I neuronala celler börjar en aktionspotential med en ström av natriumjoner in i cellen genom natriumkanaler, vilket resulterar i depolarisering, medan återhämtning innebär en utåtgående ström av kalium genom kaliumkanaler. Båda dessa flöden sker genom passiv diffusion .
En dos salt kan trigga de fortfarande arbetande nervcellerna i ett färskt kött till bränning, vilket kan orsaka muskelspasmer.
Se även
- Bioelektrokemi
- Kemiosmotisk potential
- Elektrokemisk potential
- Goldmans ekvation
- Membran biofysik
- Mikroelektroduppsättning
- Saltatorisk ledning
- Ytpotential
- Gibbs-Donnan-effekt
- Synaptisk potential
Anteckningar
- ^ Tecknen för E Na och E K är motsatta. Detta beror på att koncentrationsgradienten för kalium riktas ut ur cellen, medan koncentrationsgradienten för natrium riktas in i cellen. Membranpotentialer definieras i förhållande till cellens yttre; således innebär en potential på -70 mV att det inre av cellen är negativt i förhållande till det yttre.
Vidare läsning
- Alberts et al. Cellens molekylärbiologi . Garland Publishing; 4:e Bk&Cdr-upplagan (mars, 2002). ISBN 0-8153-3218-1 . Grundnivå.
- Guyton, Arthur C., John E. Hall. Lärobok i medicinsk fysiologi . WB Saunders Company; 10:e upplagan (15 augusti 2000). ISBN 0-7216-8677-X . Grundnivå.
- Hille, B. Joniska kanalen för exciterande membran Sinauer Associates, Sunderland, MA, USA; 1:a upplagan, 1984. ISBN 0-87893-322-0
- Nicholls, JG, Martin, AR och Wallace, BG From Neuron to Brain Sinauer Associates, Inc. Sunderland, MA, USA 3:e upplagan, 1992. ISBN 0-87893-580-0
- Ove-Sten Knudsen. Biologiska membran: teori om transport, potential och elektriska impulser . Cambridge University Press (26 september 2002). ISBN 0-521-81018-3 . Forskarnivå.
- National Medical Series for Independent Study. Fysiologi . Lippincott Williams & Wilkins. Philadelphia, PA, USA 4:e upplagan, 2001. ISBN 0-683-30603-0





![E_{eq,K^+} = \frac{RT}{zF} \ln \frac{[K^+]_{o}}{[K^+]_{i}} ,](https://wikimedia.org/api/rest_v1/media/math/render/svg/b7eb1afcc5d7a5032ff24be5c403b43b1307b01e)

![E_{m} = \frac{RT}{F} \ln{ \left( \frac{ P_{\mathrm{K}}[\mathrm{K}^{+}]_\mathrm{out} + P_{\mathrm{Na}}[\mathrm{Na}^{+}]_\mathrm{out} + P_{\mathrm{Cl}}[\mathrm{Cl}^{-}]_\mathrm{in}}{ P_{\mathrm{K}}[\mathrm{K}^{+}]_\mathrm{in} + P_{\mathrm{Na}}[\mathrm{Na}^{+}]_\mathrm{in} + P_{\mathrm{Cl}}[\mathrm{Cl}^{-}]_\mathrm{out}} \right) }](https://wikimedia.org/api/rest_v1/media/math/render/svg/4b29151571b6fb807674bf342d01f178908a1a98)