Kuwajima Taxol total syntes
Den totala syntesen av Kuwajima Taxol av gruppen Isao Kuwajima från Tokyo Institute of Technology är en av flera ansträngningar för total syntes av taxol som publicerades på 1990-talet. Den totala syntesen av Taxol anses vara ett landmärke inom organisk syntes .
Denna syntes är verkligen syntetisk utan hjälp från små biomolekylprekursorer och även en linjär syntes med molekylringkonstruktion i storleksordningen A, B, C, D. Vid någon tidpunkt låses kiralitet in i molekylen via ett asymmetriskt syntessteg som är unikt jämfört med andra insatser. I likhet med de andra försöken är svanstillsatsen baserad på Ojima-laktamen .
Ramen med 20 kol är konstruerad av flera delar: propargylalkohol (C1, C2, C14), propionaldehyd (C13, C12, C18), isosmörsyra (C15, C16, C17, C11), trimetyl(fenyltiometyl)silan (C10), 2-brombensaldehyd (C3 till C9), dietylaluminiumcyanid (C19) och trimetylsilylmetylbromid (C20)
Syntes En ring
Ring A-syntes ( schema 1 ) startade genom att förena den THP- skyddade propargylalkoholen 1.1 (C2-C1-C14-fragmentet) och propionaldehyd 1.2 (fragment C13-C12-C18) i en nukleofil addition med n -butyllitium till alkohol 1.3 . Lindlar -katalysatorn reducerade sedan alkynen till alkenen i 1,4 och Swern -oxidation omvandlade alkoholgruppen till enongruppen i 1,5 . Fragment C11-C15-C16-C17 1.6 tillsattes sedan som litiumenolatet av isosmörsyraetylester i en konjugattillsats till gamma - ketoester 1.7 . En Claisen-kondensering stängde ringen till 1,8 och den mellanliggande enolen fångas upp av pivaloylklorid (piv) som en skyddande grupp . THP-gruppen avlägsnades med TsOH till 1,9 och den bildade alkoholen oxiderades genom Swern-oxidation till aldehyd 1,10 . TIPS silylenoleter 1.11 bildades genom reaktion med triflatet TIPSOtf och DBU i DMAP vilket satte scenen för asymmetrisk dihydroxylering till hydroxialdehyd 1.12 . Piv-skyddsgruppen ersattes sedan med en TIPS-grupp i 1.14 efter att ha skyddat aldehyden som aminal 1.13 och eftersom denna grupp automatiskt förloras vid kolonnkromatografi , upprepades steget till aminal 1.15. C10-fragmentet infördes sedan med litiumsaltet av trimetyl(fenyltiometyl)silan 1.16 i en Peterson-olefinering till sulfiden 1.17 följt av avskyddning till fullbordad ring A1.18 . A-ringen är nu komplett med aldehydgruppen och desulfidgruppen på plats för förankring med ring C som bildar ring B.
| Schema 1 |
|---|
Syntes B-ring
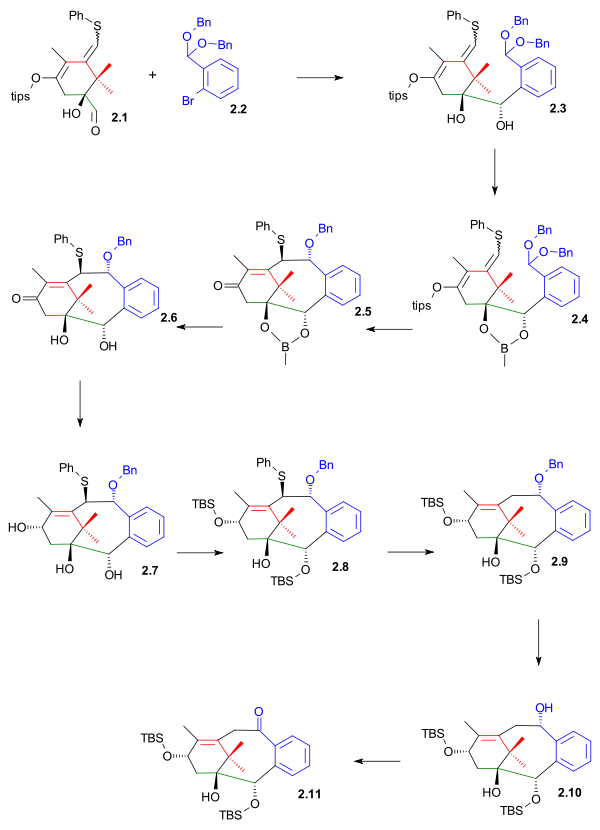
Den nedre delen av ring B konstruerades genom nukleofil addition till aldehyden av 2.1 ( schema 2 ) med dibensylacetal av 2-brombensaldehyd 2.2 som dess aryllitium . Detta steg är mycket gemensamt med B-ringsyntesen i Nicolaou Taxol totalsyntes förutom att aldehydgruppen är belägen vid ring A och inte ring B. Diolen i 2.3 skyddades som boronestern 2.4 som förberedde molekylen för den övre delen av ringen förslutning med tenntetraklorid till trecykel 2.5 i en Grob-fragmenteringsliknande reaktion.
Efter avskyddning ( pinacol ) till diol 2.6 , DIBAL -reduktion till triol 2.7 och TBS-återskyddande (TBSOtf, lutidin ) till alkohol 2.8 var det möjligt att avlägsna fenylsulfidgruppen i med en tributyltennhydrid och AIBN (se Barton-McCombie deoxygenation 29 ). . Palladium på kolhydrering avlägsnade bensylskyddsgruppen vilket möjliggjorde Swern-oxidation av 2,10 till keton 2,11
| Schema 2 |
|---|
Syntes C-ring
Komplettering av C-ringen krävde fullständig reduktion av arenen, placering av para-syreatomer och viktigare införande av C19-metylgruppen. Den första attacken mot den aromatiska ringen i 3.1 ( schema 3 ) inleddes med Björkreduktion ( kalium , ammoniak , tetrahydrofuran , -78 °C, sedan etanol ) till dien 3,2 . Avskyddning ( TBAF ) till diol 3.3 , återskydd som bensaldehydacetalen 3.4 och reduktion ( natriumborhydrid ) till alkohol 3.5 möjliggjorde oxidation av dien till 1,4-butendiol 3.6 . I denna fotokemiska [4+2] cykloaddition genererades singlettsyre från syre och rosenbengal och den intermediära peroxiden reducerades med tiourea . Nästa affär var introduktionen av C19-fragmentet: den nya diolgruppen skyddades som PMP- acetal 3.7 (PMP står för p-metoxifenyl ) vilket möjliggör oxidation av C4-alkoholen till keton 3.8 med Dess-Martin-periodinan . Dietylaluminiumcyanid reagerade i en konjugattillsats till enongruppen till nitril 3,9 . Enolen skyddades som TBS-etern 3.10 vilket möjliggjorde reduktion av nitrilgruppen först till aldehyden med DIBAL och sedan vidare till alkoholen 3.11 med litiumaluminiumhydrid . Alkoholgruppen ersattes med brom i en Appel-reaktion som orsakade en elimineringsreaktion (förlust av HBr) till cyklopropan 3.12 . Behandling med saltsyra bildade keton 3.13 , reaktion med Samarium(II)jodid gav ringöppning, vilket slutligen satte C19-metylgruppen på plats i 3.14 och avskyddning (TBAF) och enol-ketonomvandling gav hydroxiketon 3.15
| Schema 3 |
|---|
Syntes D-ring
Genom att skydda diolgruppen i triol 4.1 ( schema 4 ) som fenylboronestern 4.2 , kunde den återstående alkoholgruppen skyddas som TBS-etern 4.3 . Efter att ha avskyddat diolgruppen ( väteperoxid , natriumbikarbonat ) igen i 4.4 var det möjligt att oxidera C19-alkoholen till ketonen 4.5 med Dess-Martin-periodinan . I en ny skyddsomgång omvandlades C7-alkoholen till 2-metoxi-2-propyl (MOP)-etern 4.6 med 2-propenylmetyleter och PPTS och C7-ketonen omvandlades till dess enolat 4.7 genom reaktion med KHMDS och N,N- bis(trifluormetylsulfonyl)anilin . Dessa ingresser underlättade införandet av det slutliga saknade C20-fragmentet som Grignard-reagenset trimetylsilylmetylmagnesiumbromid som kopplades med triflatet i en tetrakis(trifenylfosfin)palladium(0) -katalyserad reaktion till silanen 4.8 . Trimetylsilylgruppen eliminerades vid tillsats av NCS till organoklorid 4.9 . Före ringslutningen av D-ringen fanns det en del oavslutade affärer i ring C. En C10-alkohol introducerades genom MoOPH-oxidation till 4,10 men med fel stereokemi . Efter acetylering till 4.11 och invertering av konfiguration med tillsatt bas DBN åtgärdades detta problem i förening 4.12 . Därefter bildade dihydroxylering med Osmium(VIII)-oxid diolen 4.13 med den primära alkoholen vid tillsats av bas- DBU som ersatte kloratomen i en nukleofil alifatisk substitution till oxetan 4.14 .
| Schema 4 |
|---|
Svanstillägg
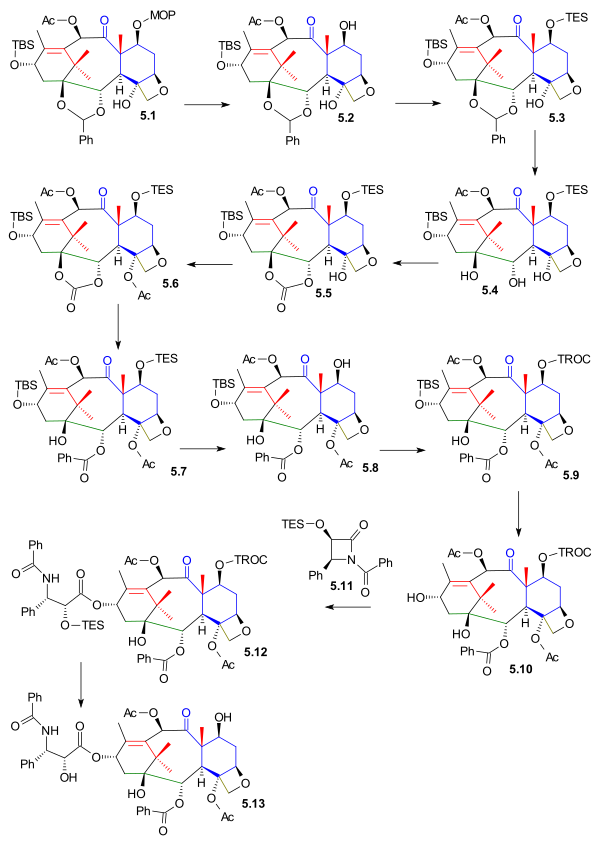
De funktionella Cl-, C2- och C4-grupperna sattes på plats härnäst och utgående från oxetan 5.1 ( schema 5 ) avlägsnas MOM-skyddsgruppen i 5.2 ( PPTS ) och ersätts av en TES-grupp TESCl) i 5.3 . Acetalgruppen avlägsnades i 5.4 ( hydrering av PdOH2 , H2 ) och ersattes med en karbonatestergrupp i 5.5 ( trifosgen , pyridin ) . Den tertiära alkoholgruppen acetylerades i 5.6 och i det sista steget öppnades karbonatgruppen genom reaktion med fenyllitium till hydroxiestern 5.7 .
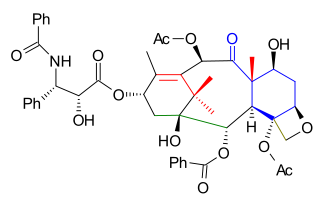
Före svanstillsats avlägsnades TES-skyddsgruppen i 5.8 ( vätefluoridpyridin ) och ersattes med en TROC (trikloretylkarbonat, TROCCl)-grupp i 5.9 . C13-alkoholskyddsgruppen avlägsnades i 5.10 ( TASF ) vilket möjliggör svanstillsats av Ojima laktam 5.11 (detta steg är vanligt med alla totala syntetiska ansträngningar hittills) till 5.12 med litiumbis(trimetylsilyl)amid . Syntesen fullbordades med avlägsnande av TROC ( zink , ättiksyra ) till taxol 5.13 .
| Schema 5 |
|---|
Se även
- Paklitaxel total syntes
- Danishefsky Taxol total syntes
- Holton Taxol total syntes
- Mukaiyama Taxol total syntes
- Nicolaou Taxol total syntes
- Wender Taxol total syntes