Kollagen hybridiserande peptid

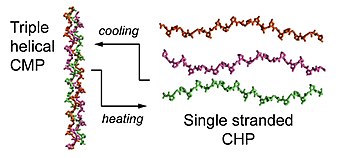
En kollagenhybridiserande peptid ( CHP ) är en syntetisk peptidsekvens med typiskt 6 till 10 repeterande enheter av Gly-Xaa-Yaa- aminosyratripletten , som efterliknar kännetecknets sekvens av naturliga kollagener . En CHP-peptid har vanligtvis ett högt innehåll av prolin och hydroxyprolin i Xaa- och Yaa-positionerna, vilket ger den en stark benägenhet att bilda kollagenets unika trippelhelixkonformation . I enkelsträngad (monomer) status kan peptiden känna igen denaturerade kollagensträngar i vävnader genom att bilda en hybridiserad trippelhelix med kollagensträngarna. Detta sker via den trippel spiralformade kedjesammansättningen och vätebindning mellan kedjorna, på ett sätt som liknar primers som binder till smält DNA- strängar under PCR . Bindningen beror inte på en specifik sekvens eller epitop på kollagen, vilket gör det möjligt för CHP att rikta in sig på denaturerade kollagenkedjor av olika typer.
Kollagen, CHP, CMP och CLP
Kollagen är huvudkomponenten i den extracellulära matrisen (ECM). Kollagensuperfamiljen består av 28 olika typer av kollagen. Även om funktionen och den hierarkiska strukturen för dessa kollagener kan variera, delar de alla den definierande strukturella egenskapen känd som trippelhelixen, där tre vänsterhänta polyprolin II-typ (PPII) helixar sätts samman för att bilda ett högerhänt supercoiled spiralformigt motiv. Korta syntetiska peptider kända som kollagenmimetiska peptider (CMPs) eller kollagenliknande peptider (CLPs) har spelat en viktig roll för att belysa 3D-strukturen av kollagentrippelhelixen, dess vikningskinetik och termiska stabilitet som små trippelspiralformade modeller. CMP, CLP och CHP är alla mycket lika vad gäller deras aminosyrasekvenser, men endast när CMP eller CLP värms över sina smälttemperaturer, existerar de i dissocierat, enkelsträngat tillstånd och kan betraktas som CHP.
Bindningsmekanism
Enkelsträngade CHP binder till denaturerade kollagenkedjor och gelatin på ett sätt som är unikt från andra målmekanismer, genom att de specifikt känner igen ett unikt strukturellt motiv ( collagen triple helix ) för vikning och kedjesammansättning, i motsats till specifika epitoper som binder, dvs. ses för monoklonala antikroppar (mAbs), till exempel. På grund av sin unika inriktningsmekanism har CHP en hög bindningsspecificitet mot denaturerade kollagenkedjor men har nästan ingen affinitet för intakt (trippelspiralformad) kollagen. CHP kan i stort sett rikta in sig på kollagenkedjor som har denaturerats genom termiska, kemiska, mekaniska eller enzymatiska processer, såväl som flera kollagentyper (t.ex. Col I , II , IV ). Studier visade också att CHP och deras fluoroforkonjugat har överlägsen stabilitet i kontakt med serum.
Denaturerat kollagen som en biomarkör för vävnadsremodellering och skada
Kontrollerad kollagenomsättning är avgörande för embryonal utveckling, organmorfogenes samt vävnadsunderhåll och reparation. Emellertid är förändringar av kollagenhomeostas förknippade med många sjukdomar och patologiska tillstånd. Överdriven kollagennedbrytning kan vara associerad med cancermetastaser , hudens åldrande , artrit och osteoporos . CHP kan rikta in sig på vävnader som genomgår ombyggnad baserat på deras förmåga att binda till nedbrutna och ovikta kollagensträngar genom trippelhelixbildning. Som en målgrupp erbjuder CHP stor potential inom histopatologi , diagnostik och läkemedelsleverans för ett brett spektrum av sjukdomar.
De flesta metoder för utvärdering av kollagendenaturering i sjukdomstillstånd är indirekta, såsom detektering av matrixmetalloproteinas (MMP) aktivitet eller kvantifiering av kollagenpeptidfragment i urin, serum eller ledvätska . Genom att använda konventionella metoder för att direkt inrikta sig på kollagen, måste forskare förlita sig på kollagenbindande peptider utvalda av fagdisplay , härledda från kollagenbindande proteiner eller antikroppar framtagna mot kollagener. Tyvärr kan dessa föreningar inte rikta sig mot denaturerade kollagener som är ostrukturerade och inte presenterar en definierad 3D-epitop. Dessutom kan antikroppar som rapporterades särskilja specifika nedbrutna kollagenfragment endast känna igen en eller få kollagentyper. Däremot kan kraftvärme i princip binda till alla typer av denaturerade kollagener.
Ansökningar
Vävnadsfärgning

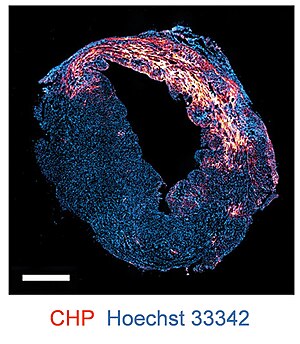
Fluorofor- eller biotinmärkta CHP används som färgningsmedel för att detektera kollagennedbrytning och denaturering via immunfluorescens och immunhistokemi . CHP kan färga frysta vävnadssnitt , formalinfixerade paraffininbäddade (FFPE) sektioner, såväl som färska vävnader. CHP är tillämpbart på vävnadsprover från flera arter och en rad sjukdomar, såsom hjärtinfarkt , artrit , nefrit och fibros .
In vivo avbildning
CHP kan också märkas med nära-infraröda fluoroforer för in vivo fluorescerande avbildning.
Kollagen identifiering
CHP kan användas för att visualisera många olika typer av kollagenband i SDS-PAGE- geler. Kollagen denatureras genom upphettning i närvaro av SDS innan gelén laddas. Kollagenbanden visualiseras genom CHP-kollagenhybridisering när gelerna färgas av fluorescensmärkta CHP.
Upptäcker mekanisk skada på bindväv
Kollagen ger mekanisk styrka i bärande vävnader i kroppen såsom senor, ligament och ben. När krafter appliceras på dessa vävnader kan trippelhelixen av kollagen skadas och varva ner, och kraftvärme möjliggör detektering av molekylär nivå av mekanisk skada i sådana bindvävar.